作者:苏晓虎, 张萱, 董秀山
文章来源:中华普通外科杂志, 2023, 38(6)
摘要
慢性便秘是最常见的功能性胃肠疾病之一,发病率连年升高,严重危害机体健康,并且发病趋势呈年轻化。原发性慢性便秘包括正常传输型便秘、直肠排空障碍和慢传输型便秘,并且亚型之间有着明显的重叠,给临床诊疗带来困难。随着对原发性慢性便秘认识的不断深入,新的诊疗策略被应用于临床。本文归纳了当前与滥用阿片类药物无关的原发性慢性便秘的定义、分型、流行病学特点、病理生理机制以及诊疗进展,旨在提高对慢性便秘的认识,为便秘的临床治疗提供有效的诊疗思路。
慢性便秘是一种胃肠功能障碍性疾病,随着人口老龄化以及生活方式的改变,发病率呈递增趋势,已成为影响人们生活质量的常见疾病之一。慢性便秘不仅对患者的工作生活产生重大影响,还引发精神、心理方面的疾病,给家庭以及社会造成负担。因此慢性便秘的诊疗对健康的生活至关重要,但目前对慢性便秘的认识普遍欠缺。本文就原发性慢性便秘的相关进展进行综述。一、概述
1.定义及分类:慢性便秘是一种常见的胃肠道疾病,这里指的是功能性便秘,即非器质性排便次数减少或排便困难。罗马Ⅳ指出慢性便秘主要表现为排便次数减少、排便困难、或有排便不尽感,可能伴有腹痛、腹胀等症状,但与肠易激综合征的诊断标准不符,症状出现至少6个月,并且近3个月内有症状。根据病因不同,慢性便秘可分为原发性便秘和继发性便秘,其中原发性便秘更为常见。原发性便秘包括3种类型:正常传输型便秘(normal-transit constipation,NTC)、慢传输型便秘(slow-transit constipation,STC)和直肠排空障碍(又称出口延迟障碍、排便障碍)。
2.发病率及危险因素:慢性便秘的全球患病率在12%~19%之间[1],与亚洲相比,便秘在北美和欧洲更为常见,这可能与饮食、文化、环境等有关。导致便秘的因素包括年龄、性别、社会地位和经济实力、体力活动程度、药物及精神状况等[2]。研究表明,压力也可能是导致便秘的重要因素之一[1]。女性便秘的发病率高于男性,与年龄呈正相关,在60岁以上的人群中便秘的发病率高达33%。怀孕期的女性因为性激素显著增加、肠道运动减少以及机械压力的改变使肠道排空延迟,更易导致便秘。
3.危害:慢性便秘可导致慢性疾病(如糖尿病、风湿病)的产生,同时伴有潜在的严重并发症,例如粪便嵌塞、大小便失禁、痔疮、肛裂、出血,甚至结肠穿孔等[3]。与正常人相比,便秘患者的健康状况以及生活质量严重受损,并且更容易出现焦虑、压力、抑郁等心理方面的疾病。
二、肠道菌群调节
人体消化系统中约有1013~1014种微生物,这些微生物分布在肠道的不同位置,影响肠道生理功能并参与对宿主至关重要的生命活动[4]。肠道菌群可参与宿主代谢,如胆固醇和胆汁酸代谢、激素代谢等,并生成一系列代谢产物,其中某些代谢产物(如吲哚衍生物、次级胆汁酸、短链脂肪酸)在维持肠道中水和电解质的平衡、肠道菌群的正常结构,甚至抗炎、肠道功能、免疫调节等方面起着举足轻重的作用。例如短链脂肪酸对便秘患者的胃肠道运动有直接的调节作用[5]。
在肠道菌群失衡的条件下会发生肠道失调,诱发或加重慢性疾病。鸟枪法测序技术的最新进展、测序成本的降低以及生物信息学手段的进步,使人们能够更全面地了解肠道菌群及其功能潜力。16S rDNA测序技术数据的主坐标分析表明,便秘患者的胃肠道菌群组成与正常个体明显不同。患者样本中微生物群的物种多样性低于健康受试者,它还伴随着双歧杆菌和乳酸杆菌的浓度显著降低以及脱硫弧菌科的丰度增加。此外,便秘患者的产丁酸细菌(如粪杆菌)水平显著降低[5]。但目前关于便秘患者的肠道菌群改变存在大量矛盾的数据,尚未有肠道菌群与原发性慢性便秘之间关系的共识。
三、原发性慢性便秘的病理生理
原发性慢性便秘通常与肠道运动紊乱或排便时盆底肌肉协调收缩功能障碍有关。根据结肠传输实验中72 h标记物排出率,可将肠道运动紊乱分为NTC和STC两大类。
1.NTC:在结肠传输实验中,NTC的72 h标记物排出率>80%[6]。虽然NTC是原发性慢性便秘中最普遍的亚型,但其病理生理学仍不清楚。结肠运动障碍不仅发生在STC中,也发生于NTC中。因此,结肠运动与结肠传输之间的关系尚不清楚。与其他功能性胃肠道疾病一样,NTC的病因也可能受饮食、生活方式、行为和心理因素等的影响。
2.直肠排空障碍:通常是由于解剖因素(如直肠前突、肛门狭窄、直肠脱垂)或肛门直肠功能障碍所致。排便协同障碍是直肠排空障碍中最常见的类型。多数患者在尝试排便时无法协调腹部、直肠、肛门及盆底肌肉,这种不协调表现为肛门反常收缩、肛门松弛不足或直肠或腹部推进力受损。排便协同障碍是一种获得性排便行为障碍。在2/3的成人患者中,它由错误的如厕习惯、排便疼痛、背部损伤或脑-肠轴功能障碍引起[7]。在排便协同障碍的患者中,传入肛门直肠诱发的神经元电位受到损害,并在生物反馈疗法后得到改善,这表明脑-肠轴受损可能是其关键机制。
3. STC:STC可能是由于潜在的肌病(结肠平滑肌功能障碍)或神经病变导致粪便延迟传输。随着病程迁延,易出现更严重的症状,尤其女性患者。一些生理学和组织生化发现被用来解释结肠传输缓慢的现象,例如胆碱能效应减少、肾上腺素能效应增强、胃肠反射减弱、直肠乙状结肠活动协同失调、肌间神经丛神经节和Cajal间质细胞的肠神经节变性,以及肠神经递质异常,如P物质、胰多肽、肽YY、神经肽Y、胆囊收缩素、血管活性肠肽、一氧化氮以及卵巢和肾上腺类固醇激素等。研究显示STC患者的排空延迟以及传输时间延长发生在升结肠和横结肠(通常在近端结肠)[8]。对严重的STC患者切除结肠的病理检查显示结肠固有神经和Cajal间质细胞明显减少[9]。虽然大多数STC病例是特发性的,但在子宫切除术或分娩后引起的骨盆神经丛损伤等也可成为STC的诱发因素[10]。
四、诊断
慢性便秘的症状通常是非特异性的,如硬便、排便不完全、肛门直肠堵塞等。根据罗马Ⅳ最新诊断标准,慢性便秘的诊断需要按以下5个步骤:①临床病史;②体格检查;③尽量少的实验室检查;④结肠镜或其他检查;⑤特殊的检查用以评估便秘的病理生理机制。临床医师首先应排除能引发便秘的器质性疾病如结直肠癌,这类疾病通常伴随着一些特定的报警征象,包括便血、不明原因的体重减轻(3个月内>10%)、发热、结直肠癌家族史或50岁以后新发的症状等。
(一)临床病史和体格检查
便秘可继发于多种疾病或药物治疗,因此明确便秘的病因至关重要。详细的病史应包括症状持续时间、排便频率、相关的症状如腹痛、腹胀及便后缓解情况等。除此之外,还应包括粪便的量、性状、粗细程度和排便的费力程度。用药史、手术史、疾病史、冶游史及吸毒史等也与便秘的发生息息相关,也应包含在病史当中。
直肠指诊对评估便秘患者非常重要,可用于排除直肠肿块或其他机械性阻塞原因(如肛门狭窄、直肠脱垂、直肠套叠),在静息状态和用力排便时观察会阴部的情况,评估排便功能,另外也可用于盆底功能障碍的诊断。研究表明,直肠指诊诊断盆底功能障碍的敏感度为75.9%,特异性为87.0%[11]。
(二)实验室检查
在进行便秘的亚型诊断之前,需根据病史和体格检查行甲状腺功能或血钙等检查以排除其他疾病引起的继发型便秘,有报警征象或所有年龄>50岁的患者皆应进行结肠镜筛查,排除结肠梗阻性病变或炎性病变。影像学检查如直肠钡剂造影、磁共振排便造影也有助于诊断肛门直肠功能障碍(协同排便障碍)以及解剖结构异常。
(三)肛门直肠功能测试
便秘的各种亚型之间所表达出来的症状有着很大的重叠。在临床实践中,确定临床表型并非必须的,但若对合理的经验性治疗(如补充纤维素、渗透性泻药)无效的患者应进行诊断性评估以识别便秘的亚型。亚型的识别可以为治疗及预后铺平道路,尤其是一线治疗无效的情况下。
1.球囊排出试验:球囊排出试验简单、可靠,可用于直肠排空障碍的诊断[12]。与此同时,该方法也有着一定的局限性,例如:未能区分直肠排空障碍的功能性和解剖学原因,异常结果需要进行额外的试验;结果正常并不能完全排除盆底肌收缩协调障碍的可能。
2.结肠/肛管直肠压力测定:常规肛门直肠测压和高分辨率肛门直肠测压是一种评估静息和收缩状态下肛门括约肌张力、直肠肛门反射、直肠感觉和排便时压力变化的生理测试,可帮助判断有无直肠、盆底功能异常或直肠感觉阈值异常。直肠肛压梯度可作为诊断排便协同障碍的有用指标,但便秘患者和健康志愿者之间的所有肛门直肠测压参数存在很大的重叠,因此该技术本身的整体诊断价值有限[13],必须与临床指标(病史、体格检查)相结合。结肠测压能够测定休息状态及食物、药物刺激后的结肠压力变化,药物治疗效果不佳的慢传输型便秘患者可考虑行结肠压力测定。但由于该方法实施的困难性以及肠道表现的差异性,目前尚未有确切的标准,仅作为一种研究工具,而非临床检查项目。
3.结肠传输试验:结肠传输试验可用多种方式来进行检测,临床应用最广泛的方法是不透射线标记检测。该项检测测量的是整个肠道传输时间,而不仅仅是结肠传输时间,尽管后者占据了整个肠道传输时间的最大比例。在临床实践中最简单和最广泛应用的方法是Hinton法:患者在当天服用1粒胶囊,其中含有20~24个不透射线标记物,然后在第5天拍1次腹部X光片。若超过20%的标记物残留,则可诊断为结肠传输缓慢;若残留标记物集中在直肠,则可诊断为出口梗阻型便秘。相对简单、较低的成本和广泛的适用性是不透射线标记物检测最容易接受的特点,然而却会导致更多的辐射暴露和额外的医院就诊。
闪烁扫描法也可用来检测结肠传输时间。该方法需口服半衰期较长的放射性同位素如111In或99Tc,根据时间进行核素成像,从而计算通过某肠段的时间。此法虽可检测结肠各节段的传输时间,但其价格昂贵,现阶段难以普及。
另一种检测肠道传输时间的方法是无线运动胶囊检测,可通过无线胶囊来检测全胃肠道的pH、压力和温度,来评估肠道传输功能。该胶囊还能够检测沿胃肠道的收缩幅度,但不能检测其传播方向。目前该方法已经被美国和欧洲胃肠运动和神经病学推荐用于结肠传输功能的检测[14]。目前推荐的慢性便秘诊疗策略如图1所示。
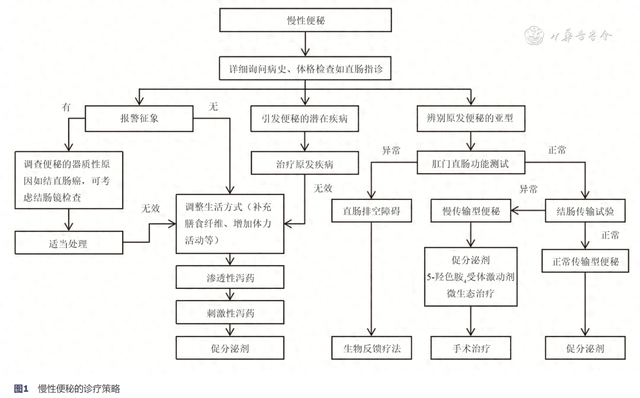
五、治疗及其预后
非药物治疗为便秘的一线治疗,效果不显著可考虑药物治疗,其中肛门直肠生物反馈疗法对于排便协同障碍的患者疗效显著。目前微生态治疗成为治疗原发性慢性便秘的一个有效且热门的治疗方法,具有很好的发展前景。对于症状比较严重且保守治疗无效,或达到手术适应证的便秘患者,手术治疗也不失为一种最后的治疗策略。
(一)非药物治疗
1.调节饮食和生活方式:调节饮食和生活方式经常被用作慢性便秘患者的一线治疗策略。这种方法的有效性是基于流行病学研究,将便秘与各种饮食和生活方式因素联系起来,例如低膳食纤维摄入量、低液体摄入量和缺乏体力活动等。驱动膳食纤维通便作用的机制各不相同:大或粗的不溶性纤维颗粒(如麸皮)机械刺激肠道黏膜,刺激水分和黏液分泌;凝胶形成的可溶性纤维(如木耳、果胶)具有很高的保水能力,可以抵抗脱水,并将水分输送到结肠以疏松大便的稠度[15]。虽然增加液体摄入量常被建议用来改善便秘患者的症状,但尚未有证据或对照试验表明增加液体摄入量对治疗便秘有效。增加有严重便秘的年轻患者的体力活动对便秘的缓解几乎没有什么帮助[1]。而对明显缺乏体力活动的老年患者来说,将增加体力活动作为整体康复计划的一部分可能对便秘有好处。
2.肛门直肠生物反馈疗法:对于排便协同障碍的患者,肛门直肠生物反馈疗法已被证明比非药物治疗(调整生活方式)、泻药或抗焦虑药物地西泮更有效,具有良好的长期效果,可作为排便协同障碍的首选治疗[16]。70%的患者对生物反馈疗法有反应,这种疗法已被美国和欧洲神经胃肠病和动力学会评为A级推荐。
(二)药物治疗
目前已被批准用于治疗便秘的药物主要有渗透性泻药、刺激性泻药、促分泌剂和5-羟色胺(5-HT)受体激动剂。
1.渗透性泻药:对于饮食和生活方式改变无效的慢性便秘患者,渗透性泻药如聚乙二醇、乳果糖是下一个常用的治疗方法。渗透性泻药可以造成肠腔内渗透梯度,导致水和电解质分泌到肠腔,从而降低粪便稠度,增加粪便体积[17]。渗透性泻药聚乙二醇在几个高质量的随机对照试验中进行了测试,试验持续时间长达6个月,与安慰剂相比,慢性便秘的症状有所改善[18]。使用渗透性泻药的目标是改善患者的主要症状。未被吸收的碳水化合物在细菌代谢下会导致产气和腹部痉挛,这可能会限制渗透性泻药的长期使用[19]。
2.刺激性泻药:若渗透性泻药疗效不显著可选择刺激性泻药加以治疗。刺激性泻药诱导水和电解质的分泌,刺激肠道运动,释放前列腺素,并加速结肠运输[20]。刺激性泻药包括二苯基甲烷衍生物(比沙可啶和匹可硫酸钠)和蒽醌衍生物(番泻叶、芦荟),通常用于治疗症状紧急的患者,例如用于2~3 d不排便的患者[19]。一项研究评估了多种刺激性泻药对便秘的疗效,结果发现使用比沙可啶每周可引发3次以上的完全自发排便,效果优于匹可硫酸钠、普芦卡必利、鲁比前列酮和利那洛肽等其他药物[21]。番泻叶也常用于慢性便秘的治疗,但目前尚无评估其疗效的安慰剂对照试验。目前很少有对刺激性泻药长期的研究或与其他药物的比较,其使用也常常受到腹痛和腹泻不良反应的限制。临床试验表明刺激性泻药有耐药性,长期使用后疗效降低。
3.促分泌剂:若患者对常规泻药无反应,则可尝试使用促分泌剂,目前可用的促分泌剂(如鲁比前列酮、利那洛肽和普利卡那肽)是通过直接作用于肠上皮细胞增加肠腔内的液体分泌来治疗便秘。鲁比前列酮通过激活管腔上皮细胞上的氯离子通道来实现这一点,而利那洛肽和普利卡那肽是鸟苷酸环化酶C受体激动剂,它们能增加肠上皮细胞内cGMP,最终导致囊性纤维化跨膜电导调节器氯离子通道的开放[22]。Li等[23]进行了一项荟萃分析,总结了9项鲁比前列酮与安慰剂的随机对照试验,结果发现使用鲁比前列酮4周后大便频率增加,便秘的严重程度得到了明显改善,并减少了劳累和腹胀,总体便秘症状得到缓解。恶心是鲁比前列酮最常见的不良反应[24]。利那洛肽可改善伴有中重度腹胀的慢性便秘患者的肠道和腹部症状,腹泻是服用利那洛肽最常见的不良反应[25]。普利卡那肽疗效与利那洛肽疗效类似[26]。
4. 5-HT4受体激动剂:普芦卡必利是一种高度选择性的5-HT4受体激动剂,它激活传入神经元的信号来增加肠道运动。一项对6个Ⅲ期和Ⅳ期随机对照试验的综合分析表明,与安慰剂相比,普芦卡必利2 mg每日1次治疗12周后,更多的便秘患者平均每周有3次或更多的自发性排便[27]。普芦卡必利耐受性较好,没有实质性的心血管效应或药物相互作用,其最常见的不良反应为胃肠紊乱(如腹泻、恶心和腹痛)和头痛。维鲁司他和纳那非利与普芦卡必利一样,都是具有促动力作用的选择性5-HT4受体激动剂。这些药物在Ⅱ期临床试验中展现出较好的前景,但尚未进一步评估。表1总结了目前治疗慢性便秘常用的药物。

(三)微生态治疗
近年来对肠道疾病和肠道菌群的研究揭示了慢性便秘与肠道菌群紊乱的关系,为微生态治疗慢性便秘提供了理论依据。鉴于其在不同胃肠道和非胃肠道疾病中的广泛作用,微生态治疗已成为潜在治疗药物中热门的治疗方法。微生物治疗方法主要包括益生菌、益生元、合生元、后生元、抗生素、菌群移植。
1.益生菌:乳酸杆菌和双歧杆菌通常用作治疗便秘的益生菌。几乎所有益生菌治疗成年人便秘的研究都表明了益生菌的有效性。Dimidi等[28]发现,用某些益生菌菌株改变肠道内环境可能会影响肠道的运动和分泌,从而使便秘患者受益。此外,益生菌可以缓解便秘,改善便秘引起的其他症状。例如,益生菌通过激活蛋白激酶信号通路来保护神经元,从而缓解便秘引起的抑郁[29]。但是,简单补充益生菌并不一定会改变人类肠道黏膜菌群组,由于宿主的特异性,益生菌及肠道菌群组在不同的宿主之间具有不同的肠道黏膜定植抗性[30],可能会影响益生菌的功能。例如,Russo等[31]的一项关于益生菌对便秘儿童影响的研究,聚乙二醇+益生菌与单独聚乙二醇治疗相比疗效并没有很大的提升。
2.益生元:益生元属于一种不易消化的碳水化合物,如低聚糖和菊糖,可增加人体常见的益生菌数量,如双歧杆菌和乳酸杆菌,从而改善便秘症状。目前可用的益生元包括人乳寡糖、乳果糖和菊粉衍生物。Huang等[32]用乳果糖治疗产后便秘患者,发现便秘症状改善明显优于对照组,包括缓解时间增加、无便秘天数延长、排便时间减少等。
3.合生元:合生元是与益生菌和益生元结合使用的生物制剂,其特征是益生菌和益生元同时发挥作用。合生元可以有效调节肠道菌群,改善大便频率、大便稠度以及便秘相关症状[33]。Bazzocchi等[34]做了一项合生元治疗便秘的研究。他们分别给予合生元及麦芽糊精(安慰剂)治疗8周,结果表明接受合生元治疗的患者在排便频率和粪便稠度方面有显著改善。此外,合生元组的结肠传输时间明显缩短,并且在合生元组半数患者的粪便样本中发现了5种对改善便秘有效的乳酸杆菌,包括天文馆乳杆菌、嗜酸乳杆菌和鼠李糖乳杆菌。在上述研究中,不良反应包括腹痛、腹胀、恶心、呕吐等很少出现。因此益生菌、益生元和合生元可能是治疗便秘的有效选择。
4.后生元:2019年国际益生菌和益生元科学协会对后生元做出了明确定义:后生元是对宿主健康有益的无生命微生物和(或)其成分的制剂[35]。肠道菌群可通过分泌调节宿主细胞和机体功能的小分子来对宿主产生影响,如吲哚及其衍生物、短链脂肪酸。这些小分子是宿主-微生物相互作用中的有效通信手段。后生元可基于这些代谢物来靶向调节菌群的下游信号通路,并通过减轻这些通路中涉及的代谢物的过量、稀缺或失调的负面影响而起作用[36]。使用后生元进行治疗的缺点之一是半衰期比使用活细菌的半衰期短,因此,可能需要重复给药来治疗与失调相关的疾病。此外,由于一些菌群相关代谢产物作用的多效性和细胞类型特异性,有必要进一步探究不同代谢物的全部生理作用。目前后生元对于治疗慢性便秘的疗效还有待研究,但这种基于代谢物的治疗策略极具前景。
5.抗生素:以往的研究已经提出了便秘与产甲烷细菌之间的联系,产甲烷肠道微生物群可通过减少排便而导致便秘的发生[37]。虽然有研究表明抗生素可以用来治疗便秘,但其不是临床上使用抗生素的主要目的。
6.菌群移植(fecal microbiota transplantation,FMT):FMT是将整个微生物群落从健康的供体转移到患者的肠道内,以取代与疾病相关的微生物组。FMT已被证明在治疗艰难梭菌感染方面具有显著的疗效[38]。FMT治疗慢性便秘的可行性已有多项研究报道。Tian等[39]进行了一项随机对照试验,其中60例STC患者被分为FMT组或对照组,并接受常规泻药治疗。结果表明,接受FMT的患者的便秘症状显著改善,包括排便频率和粪便性质。尽管样本量较小,但他们证明FMT治疗便秘是有效的。然而,由于选取捐赠者以及成本和复杂性,FMT不太可能被视为第一选择。FMT应选择性地用于对常规治疗策略不敏感的患者。
(四)手术治疗
便秘的外科治疗很少有适应证,而且需要严格的标准。手术仅适用于STC患者,不适用于盆底功能障碍导致排便不协调或便秘型肠易激的患者。对于合并排便协同障碍和STC的患者,必须在手术干预成为一种选择之前纠正盆底功能障碍[40]。
治疗慢传输型便秘的手术选择包括回肠造口术、全结肠切除与回肠直肠吻合术、盲肠顺行造口术、直肠前突、直肠套叠和直肠黏膜脱垂修复术、骶神经刺激[41]。对STC合并排便协同障碍的患者进行全结肠切除回肠直肠吻合术前,应积极考虑精神科会诊,但使用结肠切除与回肠直肠吻合术而不是单纯回肠吻合术治疗便秘尚有争议。如果盆底功能障碍首先得到纠正,合并STC和排便不协调的患者可以从全结肠切除术中受益。在存在严重的、无法纠正的盆底功能障碍的情况下,唯一能缓解症状的手术是末端回肠造口术。顺行盲肠造口术倾向于患有慢性顽固性便秘的儿童。骶神经调控疗法被认为是治疗成人慢性便秘的一种实验性疗法,国内研究表明该疗法对STC疗效显著,并且有着安全、易操作等优点[42]。
原发性慢性便秘虽然是一种消化系统疾病,但常合并精神心理障碍。对便秘缺乏重视和滥用药物是导致病程反复甚至恶化的重要因素。便秘的诊治是一个复杂的过程,便秘亚型的精确诊断是有效治疗便秘的基础,同时针对患者临床症状及病情严重程度合理规范使用治疗药物或策略至关重要,这就需要较为专业的临床团队。目前治疗便秘的药物及策略等不断进步,新兴的微生态治疗正在蓬勃发展。尽管如此仍存在着许多难题,例如便秘各亚型的病理生理机制还不清楚,其诊疗水平仍有待提高。近年来肠-脑-菌群轴的提出展现了新的探究思路,提示未来肠道菌群或许是潜在的便秘治疗靶点。
参考文献
[1]
YildirimMA, CakirM, BicerM, et al. Lifestyle and chronic constipation in medical students[J]. Gastroenterol Res Pract, 2021, 2021:4752614. DOI: 10.1155/2021/4752614.
[2]
HuangL, JiangH, ZhuM, et al. Prevalence and risk factors of chronic constipation among women aged 50 years and older in Shanghai, China[J]. Med Sci Monit, 2017, 23:2660-2667. DOI: 10.12659/msm.904040.
[3]
AlburakanA, AlshunaifiA, AlRabahR, et al. Chronic constipation that resulted in fecal impaction and colon perforation:a case report[J]. Medicine, 2022, 101(34). DOI: 10.1097/MD.0000000000030206.
[4]
TierneyBT, YangZ, LuberJM, et al. The landscape of genetic content in the gut and oral human microbiome[J]. Cell host microbe, 2019, 26(2): 283-295. DOI: 10.1016/j.chom.2019.07.008.
[5]
ZhuangM, ShangW, MaQ, et al. Abundance of probiotics and butyrate-production microbiome manages constipation via short‐chain fatty acids production and hormones secretion[J]. Mol Nut Food Res, 2019, 63(23): 1801187. DOI: 10.1002/mnfr.201801187.
[6]
任晓阳, 殷燕, 闫小妮, 等. 结肠传输试验在评估不同类型便秘患者中的临床应用[J]. 胃肠病学和肝病学杂志, 2021, 30(11): 1277-1281.
[7]
RaoSS, TutejaAK, VellemaT, et al. Dyssynergic defecation:demographics, symptoms, stool patterns, and quality of life[J]. J Clin Gastroenterol, 2004, 38(8):680-685. DOI: 10.1097/01.mcg.0000135929.78074.8c.
[8]
CamilleriM, LemboA, KatzkaDA. Opioids in gastroenterology: treating adverse effects and creating therapeutic benefits[J]. Clin Gastroenterol Hepatol, 2017, 15(9):1338-1349. DOI: 10.1016/j.cgh.2017.05.014.
[9]
American Gastroenterological Association, BharuchaAE, DornSD, et al. American gastroenterological association medical position statement on constipation[J]. Gastroenterology, 2013, 144(1):211-217. DOI: 10.1053/j.gastro.2012.10.029.
[10]
AndromanakosNP, PinisSI, KostakisAI. Chronic severe constipation: current pathophysiological aspects, new diagnosticapproaches, and therapeutic options[J]. Eur J Gastroenterol Hepatol, 2015, 27(3):204-214. DOI: 10.1097/MEG.0000000000000288.
[11]
TantiphlachivaK, RaoP, AttaluriA, et al. Digital rectal examination is a useful tool for identifying patients with dyssynergia[J]. Clin Gastroenterol Hepatol, 2010, 8(11):955-960. DOI: 10.1016/j.cgh.2010.06.031.
[12]
MinguezM, HerrerosB, SanchizV, et al. Predictive value of the balloon expulsion test for excluding the diagnosis of pelvic floor dyssynergia in constipation[J]. Gastroenterology, 2004, 126(1):57-62. DOI: 10.1053/j.gastro.2003.10.044.
[13]
GrossiU, CarringtonEV, BharuchaAE, et al. Diagnostic accuracy study of anorectal manometry for diagnosis of dyssynergic defecation[J]. Gut, 2016, 65(3):447-455. DOI: 10.1136/gutjnl-2014-308835.
[14]
RaoSS, CamilleriM, HaslerWL, et al. Evaluation of gastrointestinal transit in clinical practice: position paper of the American and European Neurogastroenterology and Motility Societies[J]. Neurogastroenterol Motil, 2011, 23(1):8-23. DOI: 10.1111/j.1365-2982.2010.01612.x.
[15]
McRorieJW, McKeownNM. Understanding the physics of functional fibers in the gastrointestinal tract: an evidence-based approach to resolving enduring misconceptions about insoluble and soluble fiber[J]. J Acad Nutr Diet, 2017, 117(2):251-264. DOI: 10.1016/j.jand.2016.09.021.
[16]
Van OutryveM, PelckmansP. Biofeedback is superior to laxatives for normal transit constipation due to pelvic floor dyssynergia[J].Gastroenterology, 2006, 131(1):333-334. DOI: 10.1053/j.gastro.2006.05.031.
[17]
FordAC, MoayyediP, LacyBE, et al. Task force on the management of functional bowel disorders. American College of Gastroenterology monograph on the management of irritable bowel syndrome and chronic idiopathic constipation[J]. Am J Gastroenterol, 2014, (Suppl 1):S2-S27. DOI: 10.1038/ajg.2014.187.
[18]
DipalmaJA, ClevelandMV, McGowanJ, et al. A randomized, multicenter, placebo-controlled trial of polyethylene glycol laxative for chronic treatment of chronic constipation[J]. Am J Gastroenterol, 2007, 102(7):1436-1441. DOI: 10.1111/j.1572-0241.2007.01199.x.
[19]
BharuchaAE, LacyBE. Mechanisms, evaluation, and management of chronic constipation[J]. Gastroenterology, 2020, 158(5):1232-1249. DOI: 10.1053/j.gastro.2019.12.034.
[20]
IkarashiN, BabaK, UshikiT, et al. The laxative effect of bisacodyl is attributable to decreased aquaporin-3 expression in the colon induced by increased PGE2 secretion from macrophages[J]. Am J Physiol Gastrointest Liver Physiol, 2011, 301(5):G887-G895. DOI: 10.1152/ajpgi.00286.2011.
[21]
NelsonAD, CamilleriM, ChirapongsathornS, et al. Comparison of efficacy of pharmacological treatments for chronic idiopathic constipation: a systematic review and network meta-analysis[J]. Gut, 2017, 66(9): 1611-1622. DOI: 10.1136/gutjnl-2016-311835.
[22]
BlackCJ, FordAC. Chronic idiopathic constipation in adults: epidemiology, pathophysiology, diagnosis and clinical management[J]. Med J Aust, 2018, 209(2):86-91. DOI: 10.5694/mja18.00241.
[23]
LiF, FuT, TongWD, et al. Lubiprostone is effective in the treatment of chronic idiopathic constipation and irritable bowel syndrome: a systematic review and meta-analysis of randomized controlled trials[J]. Mayo Clin Proc, 2016, 91(4):456-468. DOI: 10.1016/j.mayocp.2016.01.015.
[24]
CryerB, DrossmanDA, CheyWD, et al. Analysis of nausea in clinical studies of lubiprostone for the treatment of constipation disorders[J]. Dig Dis Sci, 2017, 62(12):3568-3578. DOI: 10.1007/s10620-017-4680-1.
[25]
LacyBE, ScheyR, ShiffSJ, et al. Linaclotide in chronic idiopathic constipation patients with moderate to severe abdominal bloating: a randomized, controlled trial[J]. PLoS One, 2015, 10(7):e0134349. DOI: 10.1371/journal.pone.0134349.
[26]
MinerPB, KoltunWD, WienerGJ, et al. A Randomized phase Ⅲ clinical trial of plecanatide, a uroguanylin analog, in patients with chronic idiopathic constipation[J]. Am J Gastroenterol, 2017, 112(4):613-621. DOI: 10.1038/ajg.2016.611.
[27]
CamilleriM, PiessevauxH, YiannakouY, et al. Efficacy and safety of prucalopride in chronic constipation: an integrated analysis of six randomized, controlled clinical trials[J]. Dig Dis Sci, 2016, 61(8):2357-2372. DOI: 10.1007/s10620-016-4147-9.
[28]
DimidiE, ChristodoulidesS, ScottSM, et al. Mechanisms of action of probiotics and the gastrointestinal microbiota on gut motility and constipation[J]. Adv Nutr, 2017, 8(3):484-494. DOI: 10.3945/an.116.014407.
[29]
XuN, FanW, ZhouX, et al. Probiotics decrease depressive behaviors induced by constipation via activating the AKT signaling pathway[J]. Metab Brain Dis, 2018, 33(5):1625-1633. DOI: 10.1007/s11011-018-0269-4.
[30]
ZmoraN, Zilberman-SchapiraG, SuezJ, et al. Personalized gut mucosal colonization resistance to empiric probiotics is associated with unique host and microbiome features[J]. Cell, 2018, 174(6):1388-1405.e21. DOI: 10.1016/j.cell.2018.08.041.
[31]
RussoM, GiuglianoFP, QuitadamoP, et al. Efficacy of a mixture of probiotic agents as complementary therapy for chronic functional constipation in childhood[J]. Ital J Pediatr, 2017, 43(1):24. DOI: 10.1186/s13052-017-0334-3.
[32]
HuangP, GouWL, WangXT, et al. Lactulose oral solution for the treatment of postpartum constipation[J]. J Biol Regul Homeost Agents, 2016, 30(2):523-528. PMID: 27358142.
[33]
DingC, GeX, ZhangX, et al. Efficacy of synbiotics in patients with slow transit constipation: a prospective randomized trial[J]. Nutrients, 2016, 8(10):605. DOI: 10.3390/nu8100605.
[34]
BazzocchiG, GiovanniniT, GiussaniC, et al. Effect of a new synbiotic supplement on symptoms, stool consistency, intestinal transit time and gut microbiota in patients with severe functional constipation: a pilot randomized double-blind, controlled trial[J]. Tech Coloproctol, 2014, 18(10):945-953. DOI: 10.1007/s10151-014-1201-5.
[35]
SalminenS, ColladoMC, EndoA, et al. The International Scientific Association of Probiotics and Prebiotics (ISAPP) consensus statement on the definition and scope of postbiotics[J]. Nat Rev Gastroenterol Hepatol, 2021, 18(9):649-667. DOI: 10.1038/s41575-021-00440-6.
[36]
WongAC, LevyM. New approaches to microbiome-based therapies[J]. mSystems, 2019, 4(3):e00122-19. DOI: 10.1128/mSystems.00122-19.
[37]
SahakianAB, JeeSR, PimentelM. Methane and the gastrointestinal tract[J]. Dig Dis Sci, 2010, 55:2135-2143. DOI: 10.1007/s10620-009-1012-0
[38]
QuraishiMN, WidlakM, BhalaN, et al. Systematic review with meta-analysis: the efficacy of faecal microbiota transplantation for the treatment of recurrent and refractory Clostridium difficile infection[J]. Aliment Pharmacol Ther, 2017, 46(5):479-493. DOI: 10.1111/apt.14201.
[39]
TianH, GeX, NieY, et al. Fecal microbiota transplantation in patients with slow-transit constipation: a randomized, clinical trial[J]. PLoS One, 2017, 12(2):e0171308. DOI: 10.1371/journal.pone.0171308.
[40]
LockeGR, PembertonJH, PhillipsSF. AGA technical review on constipation. American Gastroenterological Association[J]. Gastroenterology, 2000, 119(6):1766-1778. DOI: 10.1053/gast.2000.20392.
[41]
PaquetteIM, VarmaM, TernentC, et al. The American Society of Colon and Rectal Surgeons' Clinical Practice Guideline for the Evaluation and Management of Constipation[J]. Dis Colon Rectum, 2016, 59(6):479-492. DOI: 10.1097/DCR.0000000000000599.
[42]
耿龙龙, 徐红丽, 蒋宏,等. 骶神经调控疗法治疗慢性传输型便秘患者的临床疗效分析[J].中华普通外科杂志, 2021, 36(9):687-690. DOI: 10.3760/cma.j.cn113855-20201226-00957.
平台合作联系方式
电话:010-51322375
邮箱:cmasurgery@163.com
欢迎关注普外空间微信矩阵
普外空间订阅号
普外空间CLUB服务号
普外空间视频号
普外空间小助手
