
如果你问我,在肺癌诊疗的发展过程中,最重要的时间节点是哪一年?
我会毫不犹豫地回答你:2010。
就在2010年前后不过两年时间内,三项肺癌历史上至关重要的临床研究相继发布,使得后续数十年肺癌的高速发展和无数个高光时刻,由梦想照进了现实。

这三项研究按时间线排序,最早是2009年9月发表在《新英格兰医学杂志》上的IPASS研究。
这项研究由我国香港中文大学的Tony Mok教授牵头,是一项随机、开放、平行、多中心的III期临床试验,旨在比较晚期肺癌患者中吉非替尼与含铂双药化疗的疗效。IPASS研究不仅开启了肺癌靶向治疗的新纪元,也为后续的肿瘤精准治疗提供了重要的科学依据。
自此,肺癌正式进入靶向治疗的新时代,基因检测的重要性也被人们慢慢接受。
紧接着,是2011年2月发表在《胸部肿瘤杂志》上的新版肺腺癌分级系统。
自此,肺腺癌生长亚型和高危因素对预后的影响被重新审视,而那个单纯依赖TNM分期解读预后的年代,也一去不复返。
随后,是2011年8月发表在《新英格兰医学杂志》上的国际肺筛查研究(National Lung Screening Trial, NLST)。
首次在最顶级期刊以最高级别循证医学证据的形式证实:
相比传统胸片,基于CT开展的肺癌筛查可以在更早阶段发现肺癌,从而实现更好的治疗效果。
自此,正式揭开了早期肺癌CT筛查的序幕,也由此诞生了磨玻璃肺癌、实性肺癌以及实性成分百分比等足以载入肺癌史册的重要学术观点。
肺癌预后评估的三大要素:基因、病理和影像,就这么凑巧的在三个紧挨着的时间点,接连出现了。
肺癌的诊疗,正式开启了新的篇章。
今天的我们,对于同样是早期、预后却大不同的知识点早已了然于心,在临床工作中积极践行着为每位患者评估潜在复发风险、并针对其中的高危患者权衡术后辅助治疗手段的理念。
那么,如何从浩如烟海的早期肺癌患者群体中,找到高危的那部分患者呢?
今天,郑医生就借着以下几个病例,跟大家聊一聊。

病例分享#1
#1 IA期肺癌术后2年,胸膜转移
这是一名59岁的女性。
2021年3月,体检时发现右上肺2 cm实性病灶。

2021年7月,在当地医院做了手术,术后病理证实为IA3期低分化浸润性肺腺癌。
生长亚型:50%腺泡、30%乳头、10%复杂腺体和10%微乳头。
携带高危因素脉管癌栓。

基因检测携带EGFR敏感突变,术后未予以辅助靶向治疗,仅进行定期复查。
2023年7月,术后两年复查时发现癌胚抗原(CEA)增至15.48,胸部CT提示存在胸膜转移。


#2 磨玻璃肺癌术后1年,脑转移
这是一名中年男性,体检时发现右上肺46 mm磨玻璃病灶。
在完善其他检查后,未见明确转移迹象。
2023年7月11日,接受标准的肺叶切除,配合系统的纵隔淋巴结清扫。
术后病理回报低分化浸润性腺癌,30%高侵袭成分(20%复杂腺体+10%微乳头),合并脉管癌栓。
清扫淋巴结未见转移证据,0/16。
术后做了基因检测,EGFR 21 L858R突变,突变丰度28.4%,除此之外还携带了TP53突变(丰度48.3%)和PI3KCA突变(丰度21.7%)。
遗憾的是,患者术后未进行任何辅助治疗,仅予以定期复查。



2024年7月22日,复查时发现颅内转移。
回顾病史发现,尽管术前报告明确写到病灶为“混合磨玻璃密度肿块”,但电子影像中却可见该病灶为典型的纯实性肺癌。
所谓“磨玻璃”,不过是在大片的纯实性表现中,贴瓷砖片般嵌入的少量低密度区域而已。

而按现行评价标准,纯实性病灶的定义,应该是基于实性成分百分比进行测算(实性成分百分比不足100%即为磨玻璃,而实性成分100%即为实性)。
但这种内嵌小片磨玻璃的影像特点,绝不影响该病灶实性成分100%的基本事实。仅看报告中的磨玻璃表述,很容易低估病灶的侵袭性。

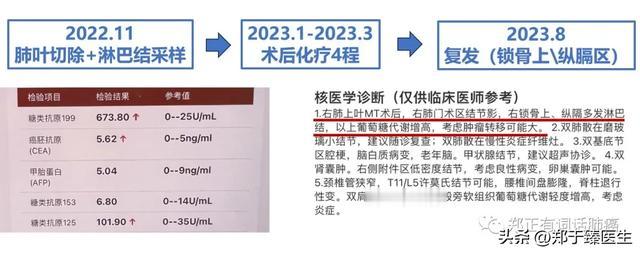
#3 IB期肺癌术后辅助化疗,半年后淋巴结转移

这是一名68岁女性,可见右上肺24 mm实性病灶。
在当地做了手术(肺叶切除+纵隔淋巴结采样):
右上肺低分化腺癌,其中,高级别亚型微乳头+筛状占比80%,剩下的是腺泡(20%),侵犯胸膜,合并气腔播散。
采样的淋巴结,均未见肿瘤残余。
其中包括的纵隔引流区淋巴结有:4组 0/1、7组 0/1。

最终,于2022年11月手术,术后做了4次化疗。2023年8月,复查时发现锁骨上/纵隔引流区淋巴结复发。
临床IA期,病理IB期肺癌,术后辅助化疗4次,半年复发。

写在最后
现在对肺癌的预后评估,绝不是仅看TNM分期这么简单,需要考虑更多的影响因素,包括:病理亚型、影像表现和基因特点。
通过细细梳理这几个病例,我们可以发现一些已经被广泛证实的证据和观点:
第一,实性肺癌存在更高的复发风险。
尽管第2个病例的病灶中间可见少许磨玻璃密度影,但贯穿病灶全程的实性成分,仍符合现阶段关于实性肺癌的定义。
而另两个病例,也无一例外,属于纯实性肺癌。
第二,在病理特点上,低分化+高危因素,是一组可能会互相联动、互相促进的临床特点。
这个过去也给大家分享过,上海胸科医院曾统计了4606例早期肺癌的治疗数据,发现病理中携带越多高危因素的患者,预后越差。
也就是说,病理中的高危因素具备叠加效应。
第三,病灶的大小很重要。
这三名复发的患者,病灶大小均>2 cm。
当实性成分占比较高时,病灶一旦达到甚至突破2 cm,即将具备较大的侵袭性,这也是JCOG 0802研究的设计者严格把握和探讨2 cm边界的原因所在。

第四,驱动基因的联动同样需要考虑。

正如2023年eClinicalMedicine所描述,在强势病理、影像的大背景下,同步携带驱动基因将带来更大的复发风险。据此,适当的术后辅助治疗可以在一定程度上降低复发风险,巩固手术治疗效果。
第五,有效的淋巴结清扫,有助于降低隐匿性淋巴结转移的风险,确保治疗效果。
第3名患者病灶较大,但仅进行了淋巴结采样。尽管接受了术后4个疗程的辅助化疗,这名患者仍在术后半年就出现复发。
这背后,可能就是淋巴结清扫范围不足带来的潜在风险。
在肺癌诊疗越来越发达的今天,循证医学证据也越来越充分,面对具体的患者情况,我们需要比过去考虑得更加全面,而不仅仅是根据简单的TNM分期预判预后,确定诊疗方案。
正如2010年先后发表的三项重磅研究所传递出的核心思想:病理、影像、基因,都是影响肺癌侵袭特点的重要因素。
在确定手术方式、淋巴清扫范围以及术后辅助治疗等方面时,均需要综合考量上述因素。
只有这样,才能站在更高的位置全面审视病情,提升疗效,做到防患于未然。
