一项新的研究揭示了铁氧还蛋白中的一种“纳米开关”,可以影响其电子转移,这可能会导致传感器和药物开发的进步。

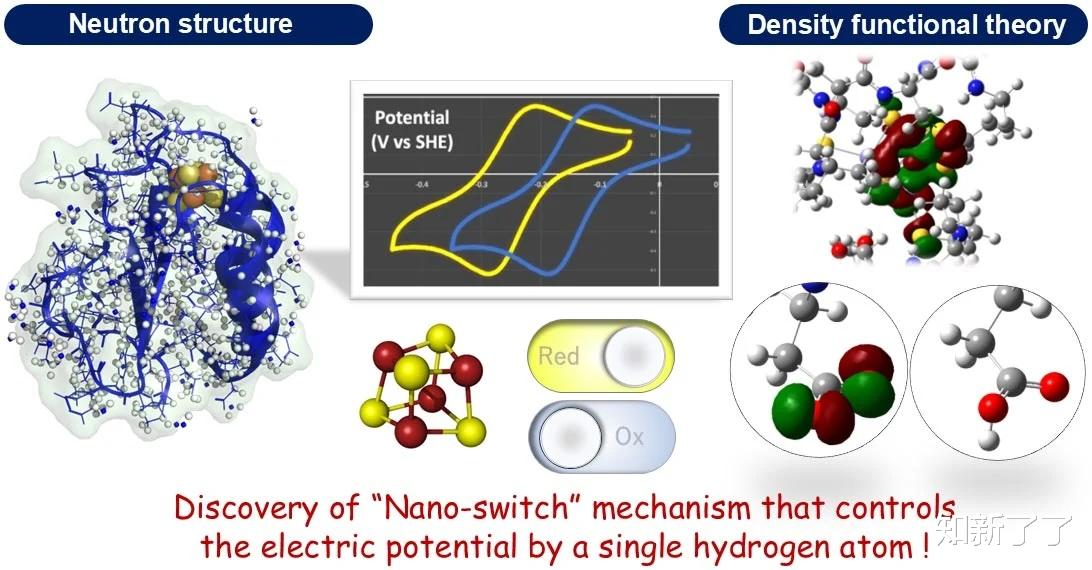
日本的研究人员发现了一种控制氧化还原反应中“电子载体”蛋白质潜力的机制,所有生物体都需要氧化还原反应来获得能量。通过实验,确定了包括氢原子在内的蛋白质的精确3D结构,并利用这些数据进行理论计算,使铁硫团簇的电子结构可视化。
研究结果首次揭示,铁硫簇的电势会随着氨基酸侧链上单个氢原子的存在或缺失而发生巨大变化,这是一种所谓的“纳米开关”机制。这项研究最近发表在《eLife》杂志上,它不仅加深了我们对生物反应的科学理解,而且为未来发展超灵敏的氧气和一氧化氮传感器以及新药提供了重要的见解。
揭示铁氧化还原蛋白中的电子转移
生物体中的大多数反应都涉及“电子”转移,称为氧化还原反应。例如,呼吸作用和光合作用可归类为氧化还原反应。一些协助电子传递的蛋白质含有铁和硫。
铁氧还蛋白是一种小蛋白质,其内部含有铁硫簇,在生物体中被称为“电子载体”。它是一种普遍存在的蛋白质,被认为存在于几乎所有的生物体中;然而,铁氧还蛋白稳定携带电子的机制至今仍是一个谜。
结构生物学的突破
在这项研究中,研究人员在日本质子加速器研究中心(J-PARC)的材料和生命科学实验设施(MLF)使用茨城生物晶体衍射仪(iBIX)进行了实验,并在中子束实验中成功地确定了铁氧还蛋白在氢原子水平上的精确三维结构。使用中子可视化蛋白质分子中的氢原子是极其困难的,据报道,整个蛋白质三维结构数据库(蛋白质数据库;PDB)中只有不到0.2%的氢原子。

洞察电子传递机制
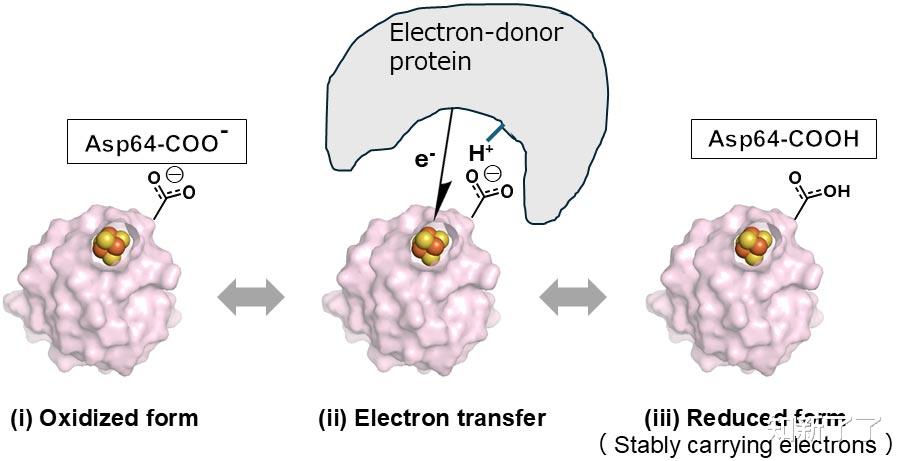
利用实验几何学(包括氢原子)进行理论计算,以阐明铁氧还蛋白中铁硫簇的电子结构。结果首次揭示了远离铁硫团簇的氨基酸残基(天冬氨酸64)对铁硫团簇中电子转移的概率有显著影响,并在铁氧还蛋白中起着控制电子转移的开关作用。此外,研究表明该机制在各种生物体中是普遍存在的。
这一结果不仅加深了我们对生物反应的科学认识,而且为未来开发氧气和一氧化氮超灵敏传感器和新药提供了重要线索。
如果朋友们喜欢,敬请关注“知新了了”!
