放射治疗是癌症治疗中常用的方法,但其对正常组织的毒性限制了治疗效果。超过60%的癌症患者在其治疗过程中会接受放射治疗,而由此引发的正常组织损伤(如口腔黏膜炎和放射性直肠炎)不仅影响患者的生活质量,还可能导致治疗中断,进而影响肿瘤控制效果。因此,如何在保护正常组织的同时增强肿瘤内的细胞毒性,是放射治疗领域亟待解决的问题。水熊虫是一种能够在极端辐射环境下生存的生物,其体内的一种损伤抑制蛋白(Dsup)能够通过与DNA结合减少辐射诱导的DNA损伤。
成果简介
鉴于此,哈佛医学院Giovanni Traverso、爱荷华大学James D. Byrne等人介绍了一种基于纳米颗粒的mRNA递送系统,能够实现Dsup蛋白在健康组织中的局部和瞬时表达,从而减少辐射诱导的DNA损伤。该研究通过设计一种聚合物-脂质纳米颗粒(polymer–LNPs),提高了mRNA的转染效率,并在小鼠模型中验证了其对口腔和直肠组织的放射保护效果。研究结果表明,该策略能够在不影响肿瘤治疗效果的情况下,显著减少正常组织的辐射损伤。


图1| 水熊虫Dsup蛋白mRNA通过纳米颗粒递送以保护口腔和直肠黏膜免受辐射损伤的示意图
聚合物-脂质纳米颗粒用于mRNA的细胞内递送
研究人员设计了一种纳米颗粒系统,用于将mRNA递送至细胞质中并翻译成治疗蛋白。通过筛选超过200种阳离子聚合物,研究人员发现聚合物#1156能够显著提高体外转染效率。进一步将聚合物与脂质纳米颗粒(LNPs)结合,优化后的配方(LNP-1156-20)在口腔上皮细胞和结肠上皮细胞中均展现出更高的转染效率。实验结果表明,聚合物的加入显著增强了LNPs的细胞内释放能力,从而提高了mRNA的表达效率。
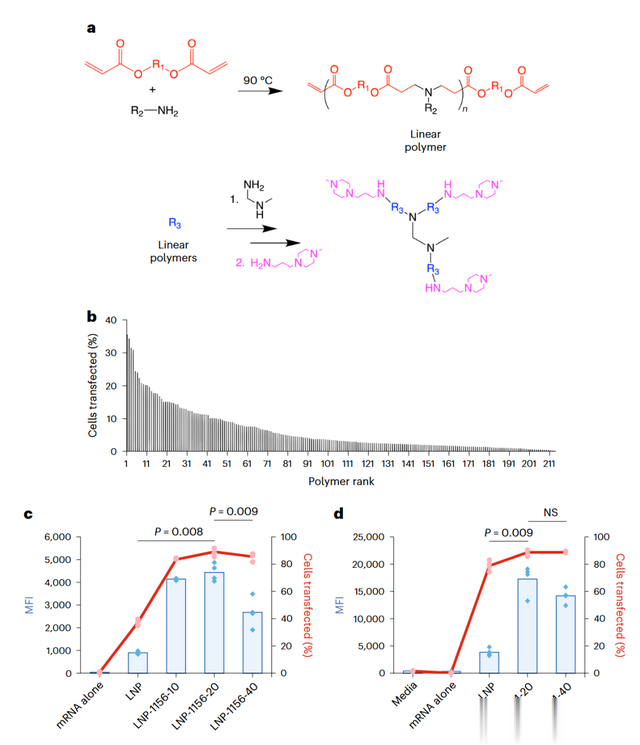
图2| 聚合物-脂质纳米颗粒用于mRNA的细胞内递送
局部注射mRNA纳米颗粒实现体内蛋白表达
研究人员通过局部注射荧光素酶(fluc)mRNA纳米颗粒,评估了其在小鼠口腔和直肠组织中的蛋白表达效果。结果显示,与单独注射mRNA相比,纳米颗粒显著提高了蛋白表达水平,且在注射后6小时达到峰值。药代动力学研究进一步表明,纳米颗粒在注射部位的分布主要局限在局部组织,未在对侧组织中检测到信号,证实了其局部保护的特性。

图3| 纳米颗粒局部递送后的体内蛋白表达
Dsup mRNA递送减少辐射诱导的DNA损伤并促进细胞存活
研究人员通过体外实验验证了Dsup蛋白的放射保护效果。实验结果表明,Dsup蛋白能够显著减少辐射诱导的DNA单链和双链断裂,并提高细胞的克隆形成能力。与传统放射保护剂WR-1065相比,Dsup mRNA纳米颗粒在低浓度下展现出更优的保护效果。此外,研究人员还通过免疫荧光和Western blot等方法验证了Dsup蛋白在细胞核内的表达,进一步证实了其放射保护机制。

图4| Dsup mRNA递送减少辐射诱导的DNA损伤并促进细胞存活
局部Dsup mRNA递送对高剂量放射治疗的保护效果
在小鼠模型中,研究人员通过局部注射Dsup mRNA纳米颗粒,评估了其对口腔和直肠组织的放射保护效果。结果表明,Dsup mRNA处理的小鼠在辐射后组织中的γ-H2AX焦点数量显著减少,表明DNA损伤程度降低。此外,研究人员还验证了Dsup mRNA纳米颗粒对肿瘤生长的影响。在口腔癌小鼠模型中,局部注射Dsup mRNA纳米颗粒并未影响对侧肿瘤的生长,表明其具有高度的组织特异性。

图5| 局部递送Dsup mRNA纳米颗粒保护正常组织免受高剂量辐射,并不影响对侧原位肿瘤的生长
小结
本研究通过开发一种聚合物-脂质纳米颗粒系统,实现了Dsup蛋白在健康组织中的局部表达,并显著减少了辐射诱导的DNA损伤。该策略不仅在体外细胞实验中表现出色,还在小鼠模型中验证了其对正常组织的放射保护效果,同时不影响肿瘤的治疗效果。这一研究为放射治疗中正常组织的保护提供了新的思路,并为基于mRNA的治疗策略提供了新的应用方向。
参考文献:
Kirtane, A.R., Bi, J., Rajesh, N.U. et al. Radioprotection of healthy tissue via nanoparticle-delivered mRNA encoding for a damage-suppressor protein found in tardigrades. Nat. Biomed. Eng (2025).
https://doi.org/10.1038/s41551-025-01360-5
