大家好!今天来了解一篇水凝胶生物电子学的研究——《Control of polymers’ amorphous-crystalline transition enables miniaturization and multifunctional integration for hydrogel bioelectronics》发表于《nature communications》。在生物电子学领域,如何让设备更好地适应生物组织并实现多功能化一直是研究重点。传统方法存在诸多局限,而水凝胶材料虽有潜力却面临挑战。今天要介绍的这项研究,创新性地通过控制聚合物的非晶 - 结晶转变,提出 COMPACT 策略。该策略不仅能使水凝胶在生理条件下稳定收缩,还实现了光学和机械性能的可调。一起看看吧!
*本文只做阅读笔记分享*
一、研究背景
(一)软生物电子设备的重要性
软生物电子设备能够在动态体内环境中适应生物组织的机械变形,为从单细胞到器官水平研究生物功能提供了可能。弹性聚合物材料,如PDMS、COCE、PU和水凝胶等,已被广泛应用于神经接口等多功能设备,以实现神经光遗传刺激、电生理记录、药物输注和神经递质检测等功能。然而,在软弹性设备中制造专用微结构的方法多局限于二维架构,且依赖复杂制造技术,如光刻和微印刷。
(二)现有技术的局限性
热拉方法:虽能实现多功能聚合物纤维的多步缩小,但对组成材料的参数要求苛刻,如玻璃化转变温度、熔点和热膨胀系数等需匹配才能拉制成集成纤维。而且高温过程限制了其在高水含量生物电子学中可用聚合物的选择。
水凝胶相关技术:水凝胶在水化和干燥状态下的机械刚度变化及体积控制特性虽已用于多种应用,如药物释放、可摄入设备和扩展显微镜等,但传统基于水凝胶溶胀和收缩的技术在体内应用时存在问题。其溶胀和收缩行为基于干燥时聚合物链的可逆塌陷及水合时的膨胀,在体内水环境中,收缩的水凝胶会膨胀,导致失去原制造的微型结构。
二、研究内容与成果
(一)COMPACT策略实现水凝胶可控收缩
1、策略原理与实施
为探索PVA水凝胶的可控小型化,同时保留其光学、抗疲劳和生物相容性等优点,设计了通过控制聚合物非晶-结晶转变的制造方法(COMPACT策略)。该策略包括三个主要步骤:
用多种交联剂实现聚合物链折叠和固定,先将TEOS水解引入PVA溶液,再添加通用交联剂GA,通过两者结合控制聚合物链的流动性和调节水凝胶折射率。
酸化处理干预水凝胶基质中分子链间相互作用,促进分子链间相互作用,抑制聚合物链折叠形成结晶。
诱导纳米晶域定向生长,对完全酸化的水凝胶进行外部机械拉伸并在干燥过程中保持,然后高温退火促进纳米晶域生长和取向。

2、尺寸与含水率变化验证
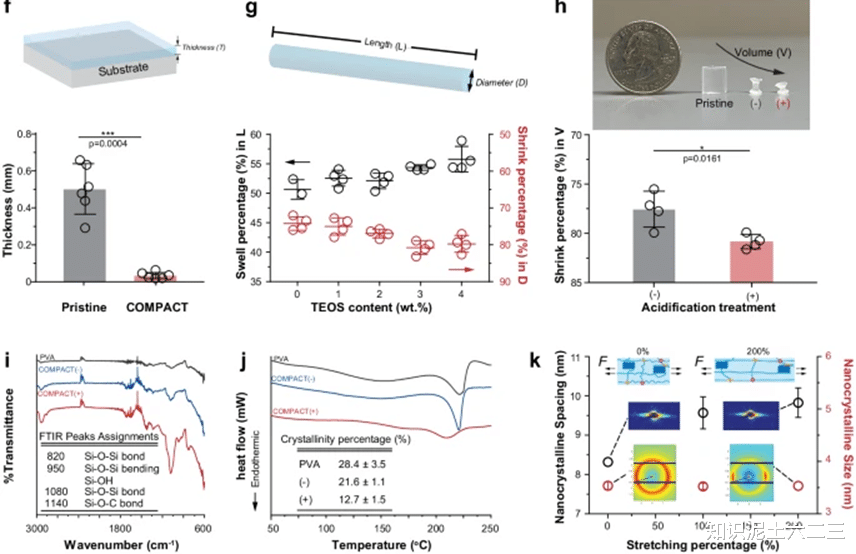
实验制备了TEOS-GA交联(COMPACT+)和GA交联(COMPACT-)的水凝胶纤维,在原始和干燥状态下,两者几何形状和含水率相当。但在再水化状态下,只有COMPACT+水凝胶纤维能保持缩小的直径,这表明COMPACT处理可使水凝胶在再水化状态下保持体积收缩。

3、收缩机制探究
通过FTIR、DSC、SAXS和WAXS等技术对水凝胶的结构和性能进行表征。FTIR结果表明COMPACT水凝胶网络中产生了共价键(Si-O-Si和Si-OH);DSC结果显示COMPACT处理后聚合物链相互作用和结晶度发生变化,PVA粉末结晶度为28.4±3.5%,GA交联的PVA水凝胶结晶度为21.6±1.1%,而TEOS交联和酸化处理抑制了聚合物链折叠形成结晶域(结晶度为12.7±1.5%);SAXS结果表明PVA纳米晶体尺寸约为3.5nm,拉伸后纳米晶间距从8.32±0.08nm增加到9.83±0.38nm;WAXS二维图案显示片晶畴沿轴向拉伸方向重新取向。
(二)COMPACT水凝胶纤维的可调性能
1、性能调控方法与结果
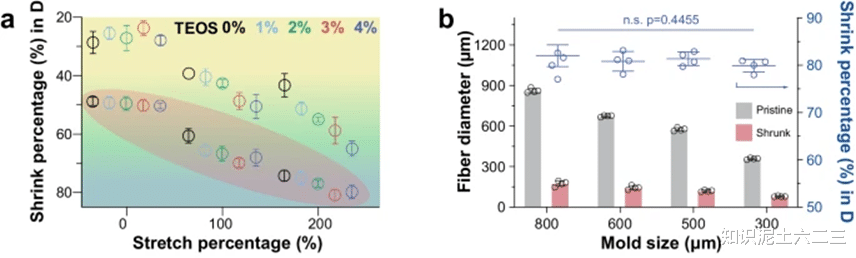
通过改变无机交联剂(TEOS)含量、酸化处理和外部机械拉伸,绘制了收缩图。增加交联剂含量、进行酸化处理和机械拉伸均可使水凝胶纤维直径减小。例如,使用不同尺寸模具制备的COMPACT水凝胶纤维,无论模具大小,其直径收缩率均超过79%。
2、光学性能
水凝胶的折射率可通过TEOS含量调节,在干燥状态下,0wt%-4wt%TEOS含量的水凝胶折射率为1.48-1.60,在水化状态下为1.37-1.40,透光率均>96%。3wt%TEOS的水凝胶综合性能最佳,折射率为1.54±0.01,透光率>96%,相对荧光单位为6.13±0.16RFU/mm。

3、机械性能
在水化状态下,COMPACT水凝胶纤维弹性模量相对较低,拉伸性较高。优化后的COMPACT水凝胶纤维(3wt%TEOS,12mMHCl酸化处理和200%拉伸,直径227±18μm)弹性模量为4.8±1.7MPa,拉伸性为139.4±26.0%。与传统的二氧化硅纤维(约20GPa弹性模量)和聚合物纤维(约1GPa弹性模量)相比,COMPACT水凝胶纤维与神经组织(1-4kPa)机械匹配性更好,轴向弯曲刚度更低,可减少对神经组织的损伤。

4、稳定性与生物相容性
在生理条件(pH6-8,37°C盐水溶液)下孵育3个月,COMPACT水凝胶纤维的收缩率保持在74%以上,表明其结构稳定性高。细胞毒性测试显示,在COMPACT水凝胶存在下,人胚胎肾细胞(HEK293)无明显细胞死亡。

(三)阶跃型水凝胶光纤
1、光纤制备与性能优化
基于COMPACT水凝胶制备阶跃型光纤,通过设计高折射率芯(n=1.40)和低折射率包层(n=1.34),并在包层中加入rGO减少光衰减。实验制备了不同结构的水凝胶光纤,如裸芯光纤、普通包层阶跃型光纤和含rGO包层的阶跃型光纤,并测试了其光传输性能。结果表明,含rGO包层的光纤光衰减系数最低,为0.94±0.25dB/cm。

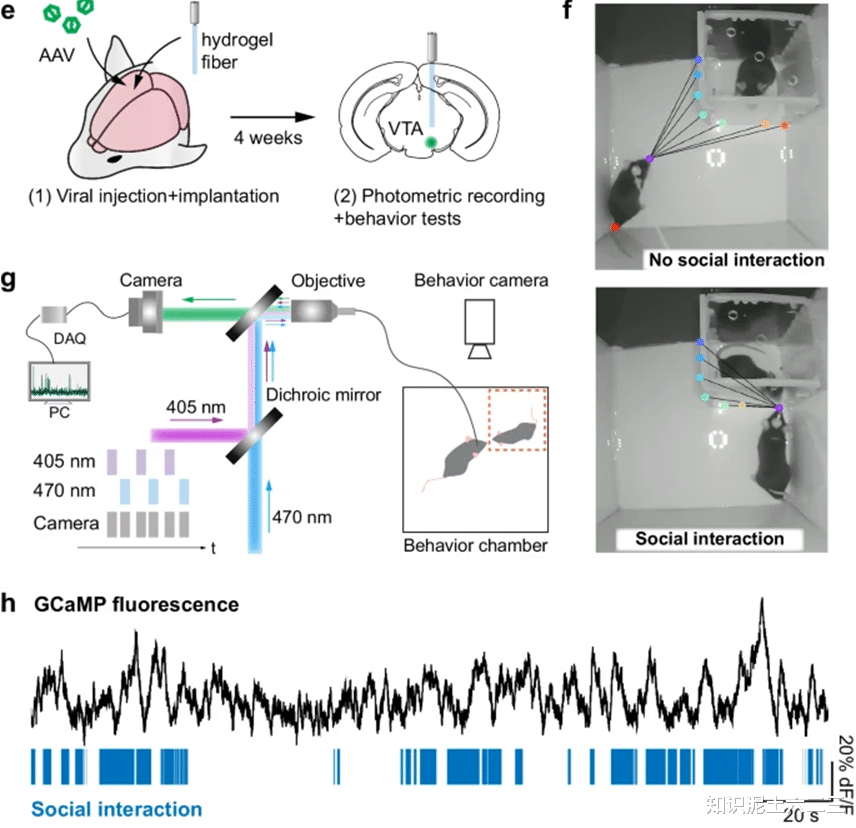
2、体内应用验证
将光纤植入小鼠VTA区域,结合光纤光度记录和社交行为测试。在小鼠VTA注射含基因编码钙指示剂(hSyn::GCaMP6s)的腺相关病毒(AAV)后,植入COMPACT光学纤维。使用光纤光度系统记录GCaMP荧光变化,同时观察小鼠社交行为。结果发现,GCaMP荧光强度增加与小鼠社交互动时期相关,表明该光纤可用于小鼠脑内神经活动的光度记录,为研究神经回路与行为的因果关系提供了重要工具。
(四)多功能水凝胶神经探针
1、电极制备与性能表征
在PVA水凝胶中引入导电CNTs(长度直径比2000-10,000:1)制备复合电极,通过酸化促进聚合物链相互作用,机械拉伸使CNTs与PVA链缠结形成导电网络。引入CNTs后,纳米结晶度变化不明显,但纳米晶体尺寸减小。CNTs-PVA复合电极的弹性模量增加,拉伸性降低,优化后的电极(0.16wt%CNTs-PVA水凝胶,直径86±5μm)阻抗为658±277kΩ,且在不同溶液中孵育和植入小鼠脑内后稳定性良好。

2、体内功能测试
电极可用于小鼠肌肉EMG记录和脑内神经元自发电活动记录。在Thy1::ChR2-EYFP小鼠中,CNTs-PVA水凝胶电极可检测到经皮光刺激(473nm,200mW/mm²,0.5Hz,脉冲宽度50ms)后hindlimb肌肉的电信号(补充图37);植入小鼠VTA后,可记录到麻醉野生型小鼠神经元的自发尖峰活动,信号信噪比约为3.73,波形可重复。

3、光电极的集成与功能实现
将水凝胶光学核心与CNTs-PVA电极集成,制备光电极。在Thy1::ChR2-EYFP小鼠中,通过光电极可实现光遗传刺激和电生理记录的同步操作。蓝色光脉冲(473nm,0.5Hz,脉冲宽度50ms,10mW/mm²)通过水凝胶光学核心激活VTA区域表达ChR2的神经元,同时CNTs-PVA电极收集神经电信号,光诱发电位在植入后10周内可重复捕获,且与光刺激起始相关。

三、研究结论
COMPACT策略为水凝胶生物电子学的小型化和多功能集成提供了一种可行的制造方法,可制备出具有稳定性能的微结构水凝胶纤维,适用于神经调制和行为学研究。
该策略具有普适性,可扩展到其他软生物电子学领域,通过集成多种功能组件,有望提高功能界面密度,克服传统纤维状神经探针的局限性,实现对复杂生物系统的多模态研究。

四、一起来做做题吧
1、以下哪种材料常用于软生物电子设备的多功能装置中,但在制造专用微结构时面临局限?( )
A. 聚二甲基硅氧烷(PDMS)
B. 石墨烯
C. 金属纳米粒子
D. 生物陶瓷
2、在 COMPACT 策略中,使水凝胶在再水化状态下保持体积收缩的关键步骤不包括以下哪项?( )
A. 引入 TEOS 和 GA 进行交联
B. 对水凝胶进行高温高压处理
C. 酸化处理
D. 外部机械拉伸
3、关于 COMPACT 水凝胶纤维的光学性能,以下说法正确的是( )
A. 所有 TEOS 含量的水凝胶透光率均为 100%
B. 随着 TEOS 含量增加,折射率不变,透光率下降
C. 3wt% TEOS 的水凝胶在水化状态下折射率为 1.54 左右,透光率 > 96%
D. 水凝胶的荧光性能与 TEOS 含量无关
4、阶跃型水凝胶光纤中,加入rGO到包层的主要作用是( )
A. 增加光纤的柔韧性
B. 提高光纤的拉伸强度
C. 降低光传输衰减
D. 增强与神经组织的相容性
5、多功能水凝胶神经探针中,CNTs - PVA复合电极的阻抗( )
A. 随着 CNTs 浓度增加而不断增大
B. 与电极直径无关
C. 可以通过设计模具尺寸和 CNTs 负载量来调节
D. 在不同溶液中孵育后会变得不稳定
6、COMPACT策略对水凝胶生物电子学的主要贡献不包括以下哪点?( )
A. 提供了一种小型化和多功能集成的制造方法
B. 仅适用于特定类型的神经科学研究
C. 可制备出性能稳定的微结构水凝胶纤维
D. 有助于克服传统纤维状神经探针的局限性
参考文献:
Huang, S. et al. Control of polymers’amorphous-crystalline transition enables miniaturization and multifunctional integration for hydrogel bioelectronics. Nat Commun 15, 3525 (2024).
