肺癌治疗有两大路线,一个是靶向,一个是免疫。
绝大多数情况下,它们就像八卦的阴阳两面,有靶向就没免疫,有免疫就没靶向。
按现有证据来说,靶向治疗因其清晰的机制研究、反复的迭代更新、优异的临床效果、轻微的毒副作用,已经成为吊打免疫的存在。
所以,临床上,有靶打靶,已经成为一个相对主流的处理方案。
但是,靶向效果一定好嘛?
今天的病例,跟大家分享一个,ALK突变,但快速耐药的患者。
让我们看看,是什么因素导致了这样的现象,也给我们一个警醒,在开展靶向治疗之前,要小心什么样的高危因素。

病例分享

这是一名39岁男性,2023年12月,体检时发现左下肺肺癌。
PET/CT显示:左肺门区见团块状高密度灶,其内糖代谢异常增高,SUVmax值为11.91,范围约72mm×58mm,边界欠清,密度不均匀,病灶累及上、下叶,左肺上叶支气管受压变窄,左肺下叶背段支气管闭塞;
左肺下叶后基底段见团块状高密度灶,其内糖代谢异常增高,SUVmax值为9.28,横径约32mm×27mm,边缘呈浅分叶,密度不均匀;
双侧锁骨区、左肺门区、纵隔内(2R区、3A区、4R区、4L区、5区、6区、7区)见多发糖代谢异常增高肿大淋巴结,SUVmax值为9.52,较大者短径约25mm。
病理结果为肺腺癌,驱动基因检测结果发现携带EML4-ALK融合突变。

患者第一时间口服阿来替尼,并在两个月后(2024年3月)复查胸部CT,发现左侧肺门区病灶明显缩小,从最早的跨肺叶压迫气管分叉的情况,退缩到偏安一隅的状态。

从上图可以看出,左下肺的转移病灶明显退缩,原先3cm左右的实性病灶,直接变成了一个不足1cm的瘢痕状改变。

纵隔淋巴结也出现了明显缓解,从图中可以看到,初诊状态下的纵隔淋巴结呈明显的阳性代谢状态,而且淋巴结明显肿大,但是这些都在口服两个月阿来替尼后得到了明显的缓解,淋巴结径线明显退缩。

所有的一切都在向好的方向发展。所以毫无疑问,患者选择继续口服靶向治疗,期待能通过这样的强效缩瘤,实现降期手术的美好愿景。
但,天不遂人愿。
2024.5.18,再次复查PET/CT时发现,病灶居然卷土重来了。
原先已经日趋干净的纵隔区,重新长满了代谢活跃的淋巴结;


而之前明显缩小的肺门肿块,也明显肿大,基本恢复至治疗前的状况。
没有一点儿预兆,长势竟如此之快。
这是一线的靶向治疗,采用的也是最经典的二代靶向药阿来替尼——有30个月疾病控制时间的良好数据。
但,为什么到了他这里,却只有前两个月的治疗看起来有效?


重新针对肺部病灶进行肺穿刺,并送检基因检测,已经出现了ALK G1202R突变。
按现有证据,这是ALK靶向药使用后最常见的一种耐药突变。
一直被大家称为“钻石突变”的ALK,以耐药时间长而得名。没想到在这个病人身上,竟然在靶向治疗两个月后就出现了耐药。
下图展示的是不同的ALK抑制剂对常见ALK耐药位点的有效性,采用的是半数抑制浓度IC50。
IC50:它是指在一定条件下,化合物或药物能够抑制生物过程或活性的浓度,使得生物过程或活性被抑制50%。
因此,IC50越低,意味着效果越好,即越有可能克服此种耐药。

从列举数据来看,针对G1202R,克唑替尼、色瑞替尼、阿来替尼、布格替尼以及洛拉替尼的IC50分别是381.6nM、124.4nM、706.6nM、129.5nM和49.9nM。
nM,即纳摩尔每升(nmol/L)的缩写,用于表示溶液中物质的浓度。
这里,虽然洛拉替尼达到了敏感标准(≤50nM),但49.9的及格线实在算不上突出,这意味着应该是一部分人有效、一部分人无效的分析结果。
而且,结合该患者既往使用阿来替尼时疗效不佳的治疗经历,抱着试一试的态度,于2024.5.24开始口服洛拉替尼(100mg/d),但是在2024.6.24复查时发现,左侧胸腔几乎已经完全被胸水和肿瘤涨满,心包积液也很明显。
随即转入ICU继续治疗。

钻石突变,经典靶向,4个月出现耐药进展,6个月广泛转移。
背后的原因到底是什么?
值得注意的是,这位患者除了驱动基因突变以外,还存在PD-L1的高表达:TPS达到80%。
难道,会和这个有关系?

PD-L1高表达的靶向治疗效果
PD-L1是用于反映免疫治疗效果的传统生物标志物,其表达水平越高,往往意味着免疫治疗的效果越好。
而在所有的肺癌群体中,同时存在PD-L1高表达且强势驱动基因的患者比例还是比较低的。
可能有人会觉得:既有驱动基因突变,又有PD-L1的高表达,可靶向可免疫,不管选择哪种治疗方案,都能取得很好的效果。即便是靶向耐药了,还有免疫这条退路,实在是令人羡慕。
真的是这样吗?

2023年,Target Oncology上曾发表过一项研究,纳入50名EGFR敏感突变患者,一线口服奥希替尼,分析显示,PD-L1高表达患者远期效果更差。
其中,PD-L1<1%、PD-L1为1%-49%和PD-L1≥50%患者群体的中位总生存时间分别是34.1月、31.6月和19.1月(P=0.029)。
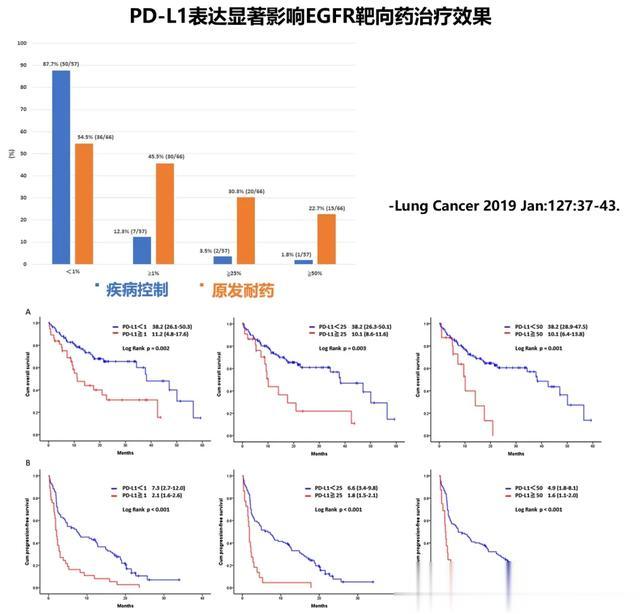
2019年,《肺癌》上刊载的一项研究中也讨论了这个问题,其纳入123名携带EGFR敏感突变且接受靶向治疗的患者资料,包括57名治疗有效和66名原发耐药的患者,发现PD-L1表达程度和治疗反应率明显相关。
在57名治疗有效的患者中,有50名患者PD-L1表达不足1%(87.7%);
而在66名原发耐药患者中,有30名检出PD-L1≥1%(45.5%)、有20名检出PD-L1≥25%(30.3%)、有15名检出PD-L1≥50%(22.7%)。
生存分析结果也显示,那些携带PD-L1高表达的患者,在针对EGFR靶向的治疗过程中,表现出更早的复发现象及更短的生存时间。

2018年,《胸部肿瘤杂志》上刊载了广东省人民医院的一项研究,纳入101名EGFR敏感突变患者一线口服靶向治疗,发现PD-L1表达有显著的预后预测价值。
其中,PD-L1高表达 vs PD-L1低表达 vs PD-L1不表达的客观缓解率为35.7% vs 63.2% vs 67.3%,疾病控制时间为3.8月 vs 6.0月 vs 9.5月。
疾病控制时间,对应不进展生存时间(PFS)。

2023年,Biomolecuules上刊载了华西医院的一项研究,纳入52名ALK突变非小细胞肺癌患者,口服靶向治疗,发现PD-L1同样表现出对远期效果的显著影响。
数据显示,接受 ALK-TKI 治疗的高 PD-L1 组和低 PD-L1 组的 PFS 中位值分别为 4.4 个月和 16.4 个月 (P= 0.008)。
两组的中位总生存期 (OS) 分别为 24.0 个月和未达到 (P= 0.021)。
PD-L1高表达组对应PD-L1≥50%,低表达组对应PD-L1<50%。

免疫治疗效果
驱动基因阳性,谁会给患者上免疫?
这个问题,如果换之前的我,也一样会有这样的思考。
但是,随着证据越堆越多,所见患者越来越多,却让我不得不怀疑这种“有靶打靶”的简单无脑处理方式是否正确。
不知道大家还有没有印象,我曾经跟大家分享过一个患者,肺鳞癌EGFR敏感突变,靶向治疗1个月进展。
他的PD-L1同样是高表达,TPS 95%。
此前,我把他的治疗效果不佳归因于肺鳞癌,现在看来,也不能排除PD-L1高表达带来的负面影响。
详见<抽丝剥茧|EGFR突变肺癌为何靶向治疗1个月就出现进展?>
靶向治疗搭台子,PD-L1拆台子?
那我们能不能换个思路?来看看免疫治疗在驱动基因阳性患者中的效果。
鉴于靶向治疗的“不可撼动”的历史地位,这类的研究非常少,但不是没有,来自罗氏的Impower 150在设计之初,就非常硬核地没有排除驱动基因阳性患者。
研究首先证实基于阿替利珠单抗的四药联合方案(阿替利珠单抗+卡铂+紫杉醇+贝伐单抗,ABCP),可以为转移性非鳞非小细胞肺癌带来更好的治疗效果。
相关不进展生存数据也在2018年登顶《新英格兰医学杂志》(中位PFS 8.3月),并于2021年在《胸部肿瘤杂志》上更新了总生存数据(中位OS 19.5月)。

2019年,其关于EGFR敏感突变的不进展生存时间的数据更新在《柳叶刀呼吸病》上,相比传统化疗+贝伐单抗(BCP)及化疗联合免疫治疗(ACP),四药联合(ABCP)方案可以在这个群体带来更好的疾病控制时间(差异达到统计学意义)。
中位PFS:ABCP VS ACP VS BCP=10.2 vs 6.9 vs 6.9
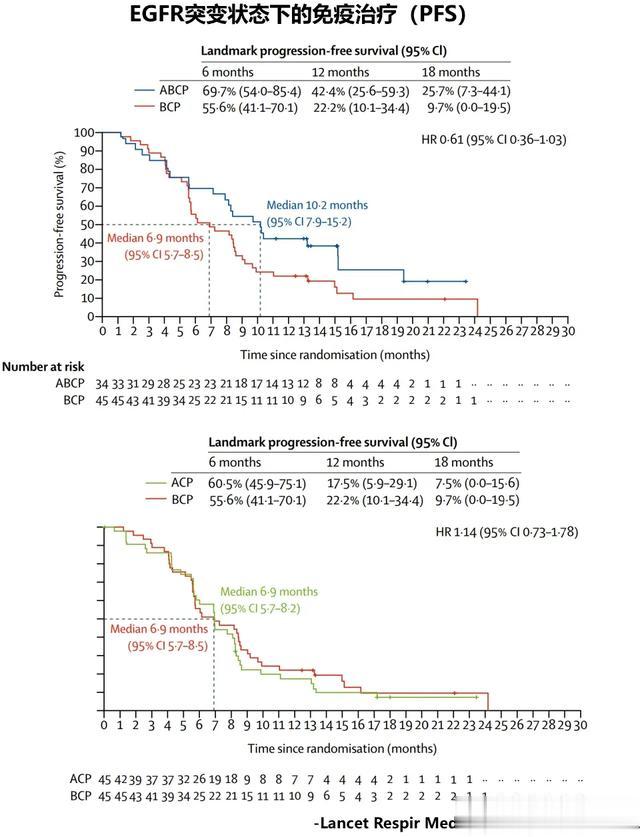
2022年,其总生存数据继续更新,并发表于《胸部肿瘤杂志》上。相比传统化疗+贝伐单抗(BCP)及化疗联合免疫治疗(ACP),四药联合(ABCP)方案可以在这个群体带来更好的疾病控制时间,但差异未能实现统计学意义。
中位OS:ABCP VS ACP VS BCP=29.4 vs 19.0 vs 18.1


写在最后
高PD-L1表达和强驱动同时存在,会发生什么?
这期的数据很好地展现了这个问题的答案。
一方面,PD-L1高表达会限制靶向药物的控制效果。
另一方面,驱动基因的存在也会限制免疫治疗发挥作用。
他就像肺癌治疗中的墙头草一样,看起来好像什么标签都带着,但却两头都讨不到好处。
所以,我们可以在研究中看到,PD-L1高表达患者更高的原发耐药几率、更短的疾病控制时间、以及更小的客观缓解率;
也可以在真实世界中发现,EGFR突变靶向一个月进展、ALK突变靶向4个月无效。
但与此同时,传统的免疫联合化疗方案,在EGFR人群中一样没有取得理想的效果,中位PFS 6.9月,中位OS 19月。
尽管现阶段的循证医学证据没办法给我们提供最佳答案,即面对这样的群体,我们的治疗方案应该以靶向为主,还是免疫为主,但联合方案或许可以作为一种选择思路。
在基因特点、肿瘤负荷都固定的情况下,面对疗效有限的治疗困局,我们更需要金刚手段。
或许是在靶向治疗的基础上引入化疗,因为从FLAURA到FLAURA2,告诉我们这样的治疗是有帮助的;
或许是在靶向治疗的基础上引入抗血管,因为CTONG-1803/ALTER-L001研究告诉我们,引入安罗替尼可以为耐药患者带来额外10个月的缓解时间;
抑或是在靶向治疗的基础上引入另一种靶向治疗,因为今年的新英格兰研究已经证实拉泽替尼和埃万妥单抗的结合可以带来超越单药的治疗效果;
当然,还可以在传统化疗联合免疫的基础上,引入抗血管治疗,因为在Impower150中,针对EGFR敏感突变人群,用这样的方案实现了10.2个月的不进展生存时间和29.4个月的总生存时间。
但无论如何选择,面对强大的敌人,都不能心存侥幸。因为留给我们的犯错空间很小,试错成本也会很高。所以,每一步的选择都需要慎重,尤其是第一步。
