中山大学肿瘤防治中心马骏院士团队在鼻咽癌防治领域取得里程碑式突破,构建了以 “增效减毒” 为核心的创新理论体系,引领国际诊疗标准从 “美国方案” 向 “中国方案” 跨越。团队首次在癌症顶刊《CA: A Cancer Journal for Clinicians》(影响因子 503.1)发表创刊以来首篇临床研究,证实诱导化疗后缩小体积放疗可显著降低毒性(CA, 2025)。近五年内,团队以第一单位在医学四大顶刊(NEJM/Lancet/JAMA/BMJ)实现全满贯(2019–2023),包括:在 NEJM 确立吉西他滨联合顺铂(GP)化疗为全球标准方案(2019),在 Lancet 揭示免疫检查点抑制剂联合放化疗的疗效(2024),在 JAMA 证实低危患者豁免化疗的安全性(2022),在 BMJ 创新保留淋巴结放疗技术(2023)。研究提出 “临床分期 + 分子标签” 精准分型策略,创建 “先化疗后放疗” 序贯模式,使晚期患者生存率提升 8.8%(85.3% vs 76.5%),同时通过免疫机制研究(Nat Med, 2023)和液体活检技术(Cancer Cell, 2024)推动个体化治疗。团队成果改写美国癌症指南 6 项、国际分期标准 5 项,两次获国家科技进步二等奖。马骏院士以多中心 III 期临床试验为核心,构建 “基础研究 — 临床转化 — 标准制定” 一体化体系,其研究被美国放射肿瘤学会评价为 “全球临床实践指南”,彰显中国在鼻咽癌领域的国际引领地位。未来研究聚焦肿瘤微环境调控与智能化诊疗,致力于实现从 “疾病治疗” 到 “健康管理” 的范式转变。
关键词:鼻咽癌;马骏;增效减毒;多中心临床试验;四大顶刊;国际指南;精准医疗
影响因子高达503.1的超级医学顶刊A Cancer Journal for Clinicians(CA)发表了其创刊以来的第一篇临床研究论文。CA 以往主要聚焦于癌症流行病学报告和综述,从未发布临床试验研究论著。这项具有里程碑意义的成果来自国内中山大学肿瘤防治中心马骏院士所领导的团队,该研究展现了中国在鼻咽癌治疗领域大型多中心III期临床试验的突破性成果,同时被美国放射肿瘤学会年会评价为“将指导全球临床实践”。
值得注意的是,发一篇医学四大顶刊 NEJM/Lancet/JAMA/BMJ 的文章,对于国人来说,是非常了不得的事情。而中山大学马骏院士的鼻咽癌防治团队做到了史无前例的成绩,不仅将四大医学顶刊全发个了遍,更是只用四年时间达成了国内最速四大医学顶刊的大满贯(2019~2023)。这位院士,到底有多厉害?今天我们就来讲讲他的故事。

马骏院士
早期教育与职业生涯
马骏院士于1963年8月出生,本科毕业于湖南医学院(现中南大学湘雅医学院),之后他进入中山大学肿瘤防治中心工作,并考取中山医科大学硕士研究生。2000年前往美国得克萨斯大学安德森癌症中心接受博士后训练。回国后马骏教授长期专注于鼻咽癌的研究,提出了“增效减毒”的治疗理念,显著提高了晚期鼻咽癌患者的生存率,并减少了治疗的毒副反应。2023年当选为中国科学院院士。
1998年至今,美国的鼻咽癌指南中诊疗路径和美国癌症联合会/国际抗癌联盟分期标准分别进行了6项和9项重大调整,其中各有5项是基于马骏的研究成果,实现了国际鼻咽癌的诊断和治疗由“美国方案”向“中国方案”的跨越。

马骏院士在查房及病例讨论
主要研究成果
马骏教授是我国具有重要国际影响力的鼻咽癌诊治专家和研究型医生,38年来他聚焦高发于我国的鼻咽癌研究,提出了两项重要理论:一是“增效”理论,即通过“吉西他滨联合顺铂化疗重塑抗肿瘤免疫,清除微小转移灶”,并制定“先化疗后放疗”的新策略,显著提高晚期患者生存率;二是“减毒”理论,通过“临床分期联合分子标签”甄别低危患者,创立“豁免化疗及缩小放疗范围”的新策略,减少毒副反应,改善患者生活质量。相关研究成果发表于CA、NEJM、Lancet、JAMA、BMJ、Nat Med、Lancet Oncol 等期刊。
马骏教授以第一完成人身份先后两次荣获“国家科技进步二等奖”,三度荣获中华医学科技一等奖、中国生命科技十大进展等;他个人还荣获何梁何利基金科学与技术进步奖、谈家桢临床医学奖、吴阶平医药创新奖等。他培养了包括长江学者特聘教授、国家杰青、国家优青等多名国家高层次青年人才,带领建立了“科技部重点领域创新团队”及“教育部创新团队”。

近五年研究方向(来源:Aminer学术)
一、鼻咽癌的放射治疗优化与临床试验
1.CA, 2025
咽癌是一种具有独特生物学特性和地域分布的恶性肿瘤,尤其在中国南方地区高发。既往针对鼻咽癌的标准治疗模式为诱导化疗后序贯同期化疗放疗,但因为传统放疗方案基于诱导化疗前的肿瘤体积设计,忽略了随着化疗疗程的进行,肿瘤体积会不断缩小的期刊,导致正常组织也遭受到了辐射,增加了治疗毒性,使得患者预后较差。
针对这一情况,近日,中山大学肿瘤防治中心马骏院士、孙颖教授团队在被业界称为“神刊”的国际肿瘤学期刊《临床医师癌症杂志》(CA)上发表了一项开放性、非劣效性、多中心、随机III期临床试验研究成果[1],这是该期刊创刊以来的全球首篇临床试验研究论著。研究结果表明:诱导化疗后缩小体积放疗方案在保证疗效的同时,显著降低了放疗的毒副作用,改善了鼻咽癌患者的生存质量。

图1 论文首页
2.BMJ, 2023
2023年2月6日,中山大学马骏团队在British Medical Journal 在线发表研究论文[2],该研究进行了一项鼻咽癌患者咽后淋巴结区保留放疗对比标准放疗的开放标签、非劣效性、多中心、随机、3 期试验。
意向治疗分析显示,保留MRLN放疗组的3年局部无复发生存率不低于标准放疗组。在对基线值进行调整后,患者报告的MRLN保留放疗后3年的结果在多个领域均较好,吞咽评分差异达到临床意义。总之,与标准放疗相比,保留MRLN放疗在非转移性鼻咽癌患者的局部复发风险方面表现出非劣效性,放射相关毒性更少,患者报告的结果更好。

图2 论文首页
值得一提的是,继NEJM、Lancet、JAMA之后,中山大学附属肿瘤防治中心马骏团队于2023年在BMJ发表研究论文。历时四年,达成医学四大顶刊的大满贯!
3.JAMA, 2022
过去关于鼻咽癌的研究大多是在高危病人提高生存做加法,随着诊疗技术的进步,对于预后好的这部分低危鼻咽癌患者做减法,减少患者的痛苦,提高生活质量也愈发重要。
为此马骏团队牵头开展了低危鼻咽癌患者单纯放疗对比同期放化疗大型的前瞻性、多中心、随机对照、非劣效3期临床试验。这一研究成果于2022年8月发表在《美国医学会杂志》上[3]。试验入组341例“低危”鼻咽癌患者,按1:1随机分配到单纯放疗组和同期放化组。
研究结果显示,在低危鼻咽癌患者中两组单纯放疗组与同期放化疗组各生存结果均相似。其中,单纯放疗组的3年无瘤生存和同期放化疗组相似。同样,3年总生存率,无复发生存率,无远处转移生存率在两组间均相似。总之,在低风险鼻咽癌患者中,单独使用调强放射治疗的3年无失败生存率,并不逊于同步放化疗。

图3 文章摘要
二、鼻咽癌的化疗及综合治疗策略
4.Lancet, 2024
抗PD-1治疗和化疗是复发或转移性鼻咽癌的推荐一线治疗,但PD-1阻断在局部区域晚期鼻咽癌患者中的作用尚不清楚。
2024年5月,中山大学马骏团队合作在国际知名医学期刊Lancet在线发表研究论文[4],该研究目的是在标准吉西他滨+顺铂诱导化疗加同步放化疗的基础上,加用信迪利单抗治疗高危局部晚期鼻咽癌的疗效和安全性。研究发现在放化疗中加入sintilimab可提高无事件生存率,尽管有较高但可控的不良事件。需要更长的随访时间来确定该方案是否可以作为局部区域晚期鼻咽癌高危患者的标准治疗方案,或许改变治疗指南!
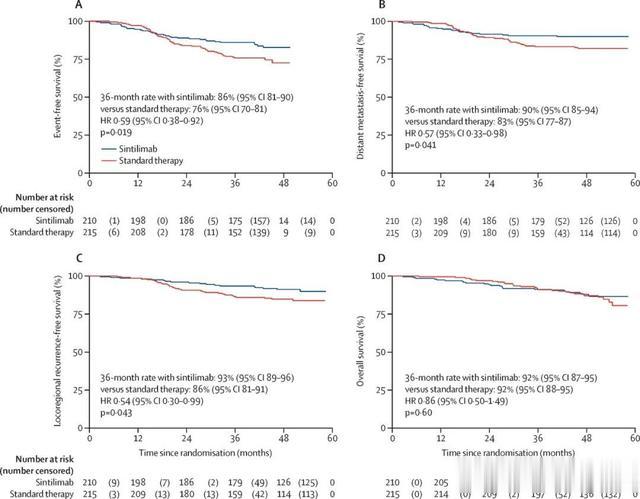
图4 意向治疗人群生存率的Kaplan-Meier分析
5.Lancet, 2021
局部晚期鼻咽癌患者有很高的疾病复发风险,尽管在接受标准治疗后达到完全临床缓解的患者比例很高。需要额外的辅助治疗来进一步降低复发和死亡的风险。然而,鼻咽癌辅助化疗的益处仍存在争议,这突出表明需要更有效的辅助治疗选择。
2021年6月7日,马骏团队在Lancet 在线发表研究论文[5],这项多中心、开放标签、平行组、随机、对照、3 期试验在中国 14 家医院进行。主要终点是无失败生存期,定义为意向治疗人群中从随机化到疾病复发(远处转移或局部复发)或因任何原因死亡的时间。在接受至少一剂卡培他滨或已开始观察的所有患者中评估安全性。总之,在放化疗中加入节拍辅助卡培他滨显著提高了高危局部晚期鼻咽癌患者的无失败生存率,安全性可控。这些结果支持节拍式化疗作为鼻咽癌辅助治疗的潜在作用。

图5 Kaplan-Meier 分析结果
6.NEJM, 2019
中国的鼻咽癌发病率居世界之冠,据世界卫生组织统计,全球近一半的鼻咽癌发生在中国。由于鼻咽癌发病部位隐蔽,70%以上患者在就诊时已经是局部进展期,治疗效果差。如何提高这部分局部进展期患者的治疗效果,一直以来都是全世界学者研究的重点。
2019年9月19日,中山大学马骏等人在NEJM在线发表题为“Gemcitabine and Cisplatin Induction Chemotherapy in Nasopharyngeal Carcinoma”的研究论文[6],该研究进行了一项多中心,随机,对照,3期临床试验,以研究局部进展期鼻咽癌患者中加入吉西他滨联合顺铂(GP)对化放疗的疗效和安全性。该研究比较了单独使用放化疗(标准治疗组)或者是吉西他滨和顺铂作为诱导化疗加放化疗的治疗效果(试验组)。该研究的主要终点是意向治疗人群的无复发生存期。总而言之,GP诱导化疗联合同期放化疗可以明显降低患者远处转移风险,进而提高无瘤生存、总生存。值得一提的是,这是中山大学首次以第一单位在NEJM发表研究性文章。

图6 四组生存率的 Kaplan-Meier 分析
三、免疫治疗与肿瘤微环境研究
7.BMJ, 2018
免疫检查点抑制剂在研制和上市方面均得到加速批准,并能快速应用到临床实践中惠及广大肿瘤患者。然而,免疫检查点抑制剂的毒性研究的进展相对落后,在缺乏足够安全性证据的情况下使用免疫检查点抑制剂可能会为患者带来疗效的同时也带来风险。因此,系统地、全面地、深入地探究不同免疫检查点抑制剂的毒性谱特征、毒性事件发生率、以及安全性排名迫在眉睫。
2018年11月8日,中山大学肿瘤防治中心马骏教授团队的一项肿瘤免疫研究结果在The BMJ杂志上在线发表[7]。该项大型网状荟萃分析研究共纳入了36项(共15,370人)采用头对头比较设计的II/III期临床试验,比较了不同类型、不同药物、不同剂量的免疫检查点抑制剂在安全性方面的优劣,详细绘制了免疫检查点抑制剂的“毒性与安全性排行榜”。该研究有助于临床医生深入了解不同免疫检查点抑制剂药物的毒性特征,为免疫检查点抑制剂所致毒性的预防、早期识别及干预提供可靠的依据,并从6个层面详细地进行了探索。

图7 基于网络荟萃分析的剂量和药物比较的网络图
8.Nat Med, 2023
2019年,马骏、孙颖教授牵头多中心单位开展了一项吉西他滨联合顺铂诱导化疗(简称GP化疗)治疗局部晚期鼻咽癌的大型前瞻性III期临床试验,采用GP化疗可将局部晚期鼻咽癌患者的长期生存率从76.5%提高至85.3%。目前,GP化疗被美国、欧洲、中国指南等以最高等级推荐为全球标准治疗方案。但GP化疗这一临床“高效低毒”的治疗方案是否以及如何调控鼻咽癌患者的抗肿瘤免疫,目前尚不清楚。
2023年,马骏/孙颖教授合作在Nature Medicine上发表了研究论文[8]。该研究发现,GP化疗介导的肿瘤细胞DNA片段释放可通过TLR9信号诱导出ILB亚群,该亚群定位于化疗诱导的类三级淋巴样结构中,通过ICOSL-ICOS信号轴促进I型辅助性T细胞(TH1)和滤泡辅助性T细胞(TFH)的扩增,进而促进细胞毒性CD8+ T细胞的杀伤功能;与此同时,其还可激活肿瘤细胞的STING-type-I-interferon通路,进而上调肿瘤细胞主要MHC I的表达。二者形成环路,最终,激活的免疫系统有效识别和杀伤鼻咽癌细胞,揭示了GP化疗免疫调节作用的新机制。

图8 研究示意图
四、分子生物学及生物标志物研究
9.Cancer Cell, 2024
利用人体体液作为标本来源检测获取肿瘤相关信息的技术被称为“液体活检” 。其作为一种新兴、无创的疾病诊断和监测工具,目前主要被应用于疾病筛查和残留病灶检测。那么,其能否应用于肿瘤患者治疗疗效和疾病复发风险的实时监测呢?目前对于这个问题的答案仍不十分清楚。
2024年7月25日,中山大学肿瘤防治中心孙颖/马骏团队在Cancer Cell上在线发表了研究论文[9]。该工作以鼻咽癌作为研究模型,通过动态追踪患者血浆中的游离Epstein-Barr病毒DNA(cfEBV DNA,一种循环肿瘤DNA)成功实现了对患者治疗响应性和复发转移风险的实时监测,为开展个体化治疗提供了可靠的生物标志物。最后,研究者探究了各时间点cfEBV DNA清零和未清零患者潜在有效的治疗策略,并提出利用治疗中cfEBV DNA的动态清零情况来帮助患者定制基于实时复发风险的个体化治疗策略,而非现有的“一成不变”的治疗模式。

图9 研究概要
写在最后
行医三十载,马骏院士最大的心愿依然是希望能够通过对肿瘤未知领域的不断探索,在鼻咽癌的发病机制和治疗手段上找到新的突破。“医学科学研究的最终目的是为患者提供更好更好的医疗服务,使更多的患者受益!”这是他经常和年轻医生讲的话。
“癌症的诊疗是全世界致力攻关的难题,是无数肿瘤患者绝望中唯一的希望所在。这条路很长,我们要和患者一起走下去。”他坚信,医学探索永无止境,唯有步步向前,直至远方。
