细胞宝宝很娇弱,所以需要呵护照料。细胞培养需要无菌的环境,以保证无微生物污染。
如何准备无菌环境呢?
1. 实验进行前,无菌室及无菌操作台以紫外灯照射30-60分钟灭菌,以酒精擦拭无菌操作抬面,并开启无菌操作台风扇运转10 分钟后,才开始实验操作。每次操作只处理一株细胞株,且即使培养基相同亦不共享培养基,以避免失误混淆或细胞间污染。实验完毕后,将实验物品带出工作台,以酒精擦拭无菌操作抬面。操作间隔应让无菌操作台运转10 分钟以上后,再进行下一个细胞株之操作。
2. 无菌操作工作区域应保持清洁及宽敞,必要物品,例如试管架、吸管吸取器或吸管盒等可以暂时放置,其它实验用品用完即应移出,以利于气流之流通。实验用品以酒精擦拭后才带入无菌操作台内。实验操作应在抬面之中央无菌区域,勿在边缘之非无菌区域操作。
3. 小心取用无菌之实验物品,避免造成污染。勿碰触吸管尖头部或是容器瓶口,亦不要在打开之容器正上方操作实验。容器打开后,以手夹住瓶盖并握住瓶身,倾斜约45°角取用,尽量勿将瓶盖盖口朝上放置桌面。
4. 工作人员应注意自身之安全,须穿戴实验衣及手套后才进行实验。对于来自人类或是病毒感染之细胞株应特别小心操作,并选择适当等级之无菌操作台。
5. 定期检测下列项目:
1)CO2 钢瓶之CO2 压力
2)CO2 培养箱之CO2 浓度、温度、及水盘是否有污染(水盘的水用无菌水,每周更换)。
3)无菌操作台内之空气流动压力,定期更换紫外线灯管及空气过滤器过滤膜。
6. 水槽可添加消毒剂,定期更换水槽的水。
在无菌环境下,细胞培养还需要合适的空间哦细胞培养需要控制细胞所处的温度、pH、渗透压、O2和CO2。
pH:大部分细胞在pH 7.4左右生长良好。
CO2:一般需要在专用的二氧化碳培养箱中培养,设置为5% CO2。
温度:大部分哺乳动物细胞培养温度为37°C。禽类细胞在38.5°C生长最佳。昆虫细胞最佳生长温度是27°C。冷血动物细胞系可在15-26°C范围内培养。
细胞培养容器:大多数细胞系在专用的细胞培养瓶上生长,不需要特殊的基质等。但一些细胞,特别是原代细胞,需要在特殊的基质(如胶原蛋白)上生长,以促进细胞贴壁、分化或生长。

细胞培养又具体分为细胞传代、换液、冻存、复苏等一系列过程,每个步骤都对应着不同的操作技术要点,想要养好细胞,每一步都必须掌握。
细胞传代
一般细胞融合度达到约80%(即80%的培养瓶表面被单层细胞覆盖)时,即需要进行传代培养。不建议细胞过度融合(达到100%)时传代,因为这可能会影响细胞活性。
细胞传代需要注意分板比/接种密度。不同的细胞系通常需要满足特定的分板比/接种密度,务必查看所用细胞系的培养指南。生长较快的细胞可能需要高分板比(低接种密度),而生长缓慢的细胞可能需要低分板比(较高接种密度)。
如果细胞长时间无人看管(例如公共假日或周末),建议使用低于正常水平的分板比/接种密度。但是一些细胞,特别是原代细胞生长具有密度依赖性,过低的接种密度可能导致无法生长。
细胞分板比/接种密度需要通过对样品中的细胞计数确定。细胞计数一般可使用血细胞计数板。

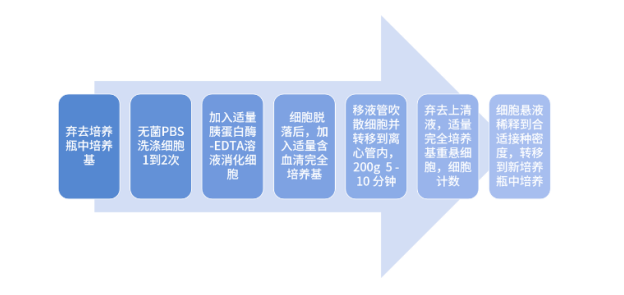
01. 贴壁细胞系>>
贴壁细胞一般需要使用胰蛋白酶等消化液,但其可能会损伤细胞,还可能会诱使某些膜蛋白暂时内化。这时,可使用其他温和消化试剂替代(推荐产品:埃泽思PSC温和消化酶AC-1001004)。操作步骤:
注意点:
PBS洗涤(推荐产品:埃泽思PBS/磷酸盐缓冲液(不含钙.镁)AC-1001037)是为完全除去残留的胎牛血清(FBS)、钙和镁等。必要时可多次洗涤(某些细胞系贴壁牢固,需多次冲洗才能彻底去除残留 FBS),促进胰蛋白酶消化。
胰蛋白酶用量以覆盖培养瓶底部为宜,轻轻转动培养瓶,确保消化液与所有细胞接触。
将培养瓶放入37℃ 培养箱中,更适合消化酶的消化。不同细胞消化时间不同,为避免因过度消化而严重破坏细胞,必须每隔几分钟进行一次检查。
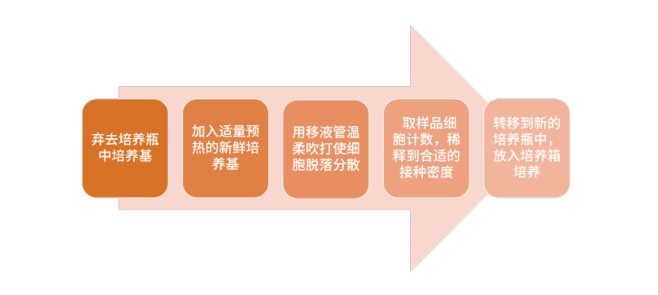
02. 半贴壁细胞系>>
一些细胞系介于悬浮和贴壁细胞之间,针对松散贴壁细胞,可不使用消化液,而使用移液管温柔吹打,使细胞分散。操作步骤:
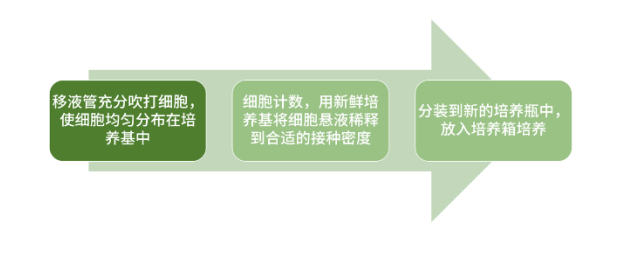
03. 悬浮细胞系>>
悬浮细胞传代难度略低于贴壁细胞,无需经消化处理。操作步骤:
注意点:
一些悬浮细胞生长过程中可能结团,可添加解离试剂使团块分散。
悬浮细胞多次传代后,细胞碎片和代谢废物会不断积累,可将细胞悬液以 100Xg离心5-10分钟,弃去上清液,将细胞沉淀重悬在新鲜培养基中。
细胞冻存
利用冻存技术将细胞置于-196℃液氮中低温保存,可以使细胞暂时脱离生长状态而将其细胞特性保存起来,这样在需要的时候再复苏细胞用于实验。
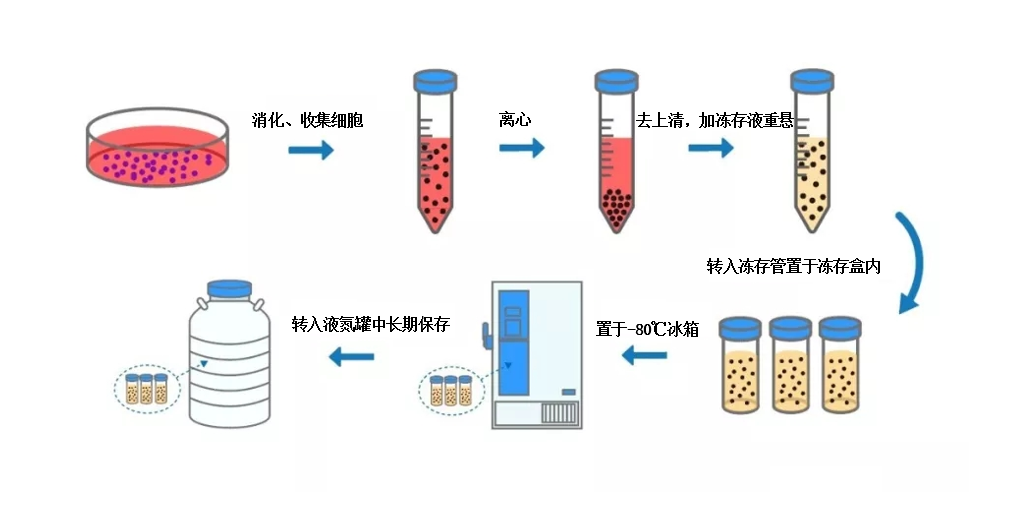
操作步骤:
1. 细胞达到90%汇合度,吸掉原有培养基,PBS清洗一次。
2. 加入细胞消化液使之完全覆盖皿/瓶底,室温孵育4-5min或37℃孵育2-4min分钟,显微镜下观察大部分细胞脱离皿底即停止消化。
3. 加入消化液2倍体积的人间充质干细胞培养基,用移液枪轻轻吹打瓶壁上未完全脱离的细胞,并轻轻吹打混匀,使细胞完全分散。
4. 将细胞悬液转移到15mL离心管中,1200rpm离心3min,吸掉上清。
5. 加入适量无血清细胞冻存液(推荐产品:埃泽思无血清细胞冻存液(治疗级) AC-1001006),调整细胞冻存密度在1×106cells/mL左右,每支冻存管分装1.5-2ml。
6. 直接放入-80℃,24h后转入液氮中长期保存。
注意点:
1. 细胞如果是第一次养,建议至少冻存两个批次以上,以尽量避免因为冻存问题导致细胞绝种;
2. 如果没有程序降温盒,可以将冻存细胞依次放于4℃1h,-20℃2h,-80℃过夜,大部分细胞也可以适应,但原代细胞不建议这么处理。
细胞复苏
细胞复苏是指将休眠的细胞重新活化,使之重新生长,分裂产生子细胞的过程。复苏后的细胞可重新进入细胞周期,获得细胞类型特异的生物学功能。复苏细胞一般采用快速融化法,以保证细胞外结晶快速融化,避免慢速融化产生的水分渗入细胞内,再次形成胞内结晶损伤细胞。
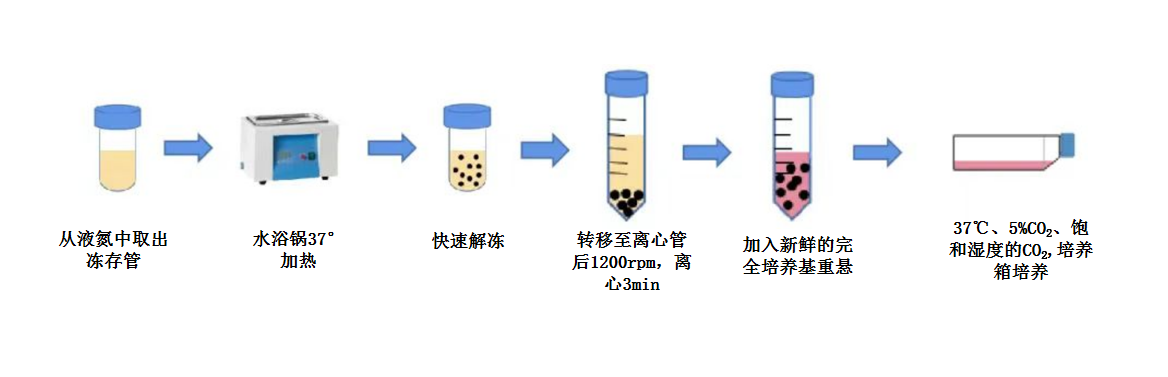
1. 从液氮中取出冻存的细胞,迅速将冻存管放入37℃水浴快速融解。
2. 在生物安全柜或超净台中,将解冻后的细胞悬液缓慢加入5mL预温的细胞培养基(推荐产品:埃泽思人脐带间充质干细胞无血清培养基AC-1001043)。
3. 1200rpm 离心3min,吸掉上清,加入10mL培养基重悬细胞。
4. 将细胞均匀铺到培养皿中,水平十字振动培养皿使细胞均匀分布,5% CO2的 37℃恒温细胞培养箱中培养24小时后观察细胞状态。
5. 24h后更换新鲜细胞培养基继续培养,每2-3天更换培养液。
注意点:
1. 从液氮罐中拿出冻存管时要做好防护工作,需配备防冻手套和护目镜;
2. 水浴锅温度:严格控制在37℃,且解冻时冻存管管口切勿浸没到水中;
3. 复苏接种密度:一管细胞(1×106个)接种到1个T25(底面积25cm2)中,摇匀后置于37℃、5%CO2的培养箱中培养。
埃泽思产品推荐
AC-1001004 PSC温和消化酶 100mL
* 对细胞消化温和,减少对PSC细胞膜结构破坏;
* 消化后细胞可直接贴壁,简化传代流程:
* 无动物源,质量稳定,无批间差异;
* 低热源,内毒素水平<0.12EU/mL,适用于细胞治疗应用。

AC-1001006 无血清细胞冻存液(治疗级)100mL
* 所有成分均为原料药级别,合规性高,符合药品申报要求;
* 无动物源成分,无各类病毒、细菌,霉菌和支原体等污染;
* 即用型产品,无需程序降温,冻存于-80℃冰箱或液氨中长期保存;
* 低热源,减少外源内毒素干扰,适用于细胞治疗应用;
* 冻存细胞复苏率高,常见细胞复苏率普遍高于95%。

AC-1001043/(PRF) 人脐带间充质干细胞无血清培养基/(PRF) 基础培养基450mL,添加剂50mL
* 专为脐带间充质干细胞分离与扩增优化,传代稳定性高,最高可达20代
* 全程无血清生产,极大降低批次间差异
* 可用于原代分离,且培养过程无需包被培养板;
* 无外源动物成分,大大降低各类病毒,霉菌和支原体等的污染风险
* 低热源,内毒素水平<0.12EU/mL,适用于细胞治疗应用。

AC-1001037 磷酸盐缓冲液(不含钙.镁) 500mL
* 使用细物培养级水配制,无重全属离子以及其他杂质
* 0.1um 过滤,无细菌,无真菌,无支原体
* 内毒素<0.06EU/ml,远低于中国药典水平
