*仅供医学专业人士阅读参考
点击右上方“关注”,准时接收每日精彩内容推送。
经皮热疗是一种微创手术程序,通过靶向传递热来消融深部肿瘤病灶。传统的热烧蚀方法,如射频或微波烧蚀,在一定程度上会受到较长的烧蚀时间以及不必要的过热的生物安全风险。鉴于其有效性和安全性,经皮热疗由于磁热疗而获得了全新的视角。在这方面,基于注射和磁性水凝胶结构的热消融剂很可能是上述临床转化的候选者。
鉴于此,合肥工业大学陆杨教授联合中国科学院杭州医学研究所董良研究员和俞书宏院士团队采用简单环保的方法,采用超顺磁性纳米Fe3O4和明胶组成的二元体系制备了一种磁性胶体水凝胶注射剂。与传统的散装水凝胶不同,胶体水凝胶结构可以很容易地通过经皮针挤出,然后由于独特的静电交联而以可逆的方式自愈。这种水凝胶注入能够不受深度渗透的限制而产生热量。该材料在小型和大型动物模型中均取得了出色的治疗效果(图1)。
相关研究成果以“Minimally Invasive Delivery of Percutaneous Ablation Agent via Magnetic Colloidal Hydrogel Injection for Treatment of Hepatocellular Carcinoma”为题于2024年3月6日发表在《Advanced Materials》上。
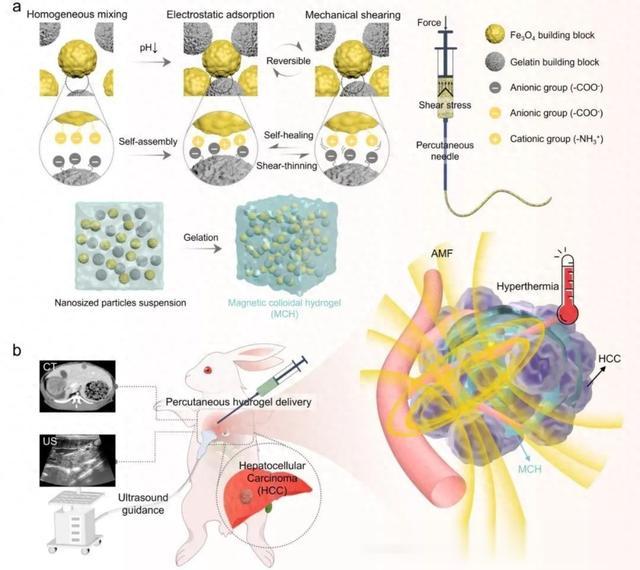
图1 超声引导下肝细胞癌磁热消融注射用水凝胶消融剂的设计与制备
1. 可注射磁性胶体水凝胶(MCHs)的制备与表征
图2a显示了可注射胶状水凝胶的制备过程,二元混合物在碱性条件下(pH≈10)保持类液体状态,随着pH值的降低,其自发交联形成类固体状态,微观水平下荧光标记混合纳米颗粒悬浮液也是如此。为了精确控制水凝胶的形成,研究者建立了保证胶体之间存在静电斥力的初始基本条件,然后观察加入D-(+)-葡萄糖酸δ-内酯(GDL)后pH值随时间的变化。基于zeta电位的明胶NPs呈现出pH依赖的反转,而Fe3O4 NPs则保留了负电荷(图2b)。如图2c所示,当pH低于等电点(IEP)时,流体动力直径的变化证明了聚集体的形成,也暗示了pH诱导的静电组装。宏观糊化过程通过连续流变数据揭示了从类流体到类固体行为的转变(图2d)。流变测试显示,MCH4表现出较好的粘弹性(图2e)。SEM图显示:Fe3O4 NPs和明胶NPs均呈现均匀的球形形状(图2f)。图2g显示了组装颗粒的连续胶体网络和铁、碳、氮、氧等元素的均匀分布。
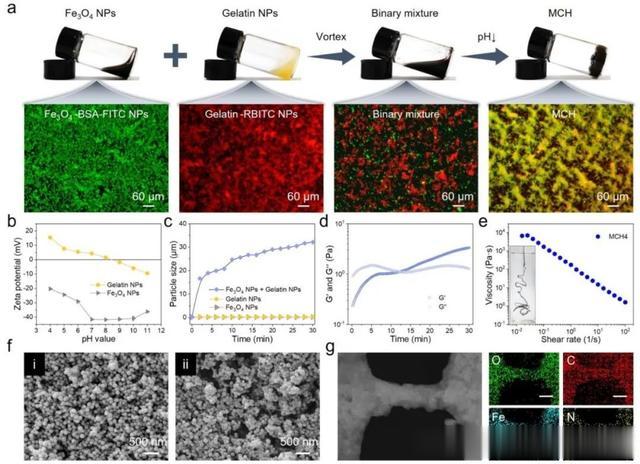
图2 MCHs的制备与表征
2. 临床经皮针注射MCHs的可注射性
含有磁性Fe3O4 NPs的胶体水凝胶的内在可注射性会增强,因为它们的界面接触相对较弱(图3a)。Fe3O4 NPs的空间分布也可能对注射性产生影响,在某些情况下会因聚集而降低注射性。为了探索这些结构差异,我们制作了两种类型的水凝胶:含有Fe3O4 NPs的胶体水凝胶(MCH4)和掺杂Fe3O4NPs的散装水凝胶(表示为磁性水凝胶,MH4)。对比Fe3O4 NPs的微观空间分布,MCH4表现出相对均匀的颗粒状网络,并具有连续的构建块界面堆积,而冻干后的MH4在微观水平上呈现出典型的Fe3O4 NPs凝聚的互穿链网络(图3b)。图3c-d说明材料具有明显的注射性。
然后研究者基于经皮针头尺寸、注射速度和材料成分,进行了典型的挤出研究。使用较窄的经皮针,注射需要更大的力,注射速率也更高(图3f-h)。图3i显示了温度诱导下挤压长丝宏观形貌的变化。在下降的过程中,无论是在室温还是在体温下,MCH4都保持连续的悬丝。而MH4在37.0 ℃下经历了从细丝到分散体的解离过程,并有Fe3O4 NPs的泄漏。

图3 临床经皮针注射MCHs的可注射性
3. MCHs的体外磁致加热性能
考虑到水凝胶的磁性和特定交变磁场(AMF)的存在,它将赋予水凝胶磁感应加热的能力,从而扩大其潜在的应用范围。图4a显示了材料的磁响应性。此外,当水凝胶总固含量一定时,水凝胶中Fe3O4NPs的掺入量可能是决定AMF致热性能的关键参数(图4b-c)。图4d显示了MCH4 (18.767 mg Fe/mL)随磁场强度变化的加热性能,以及红外热像(图4e)。循环测试显示了材料优异的加热稳定性(图4f)。

图4 MCHs的体外磁致加热性能
4. 暴露于MCH4的生物相容性和磁热杀伤能力的评价
为了确定直接暴露于MCH4时的细胞活力,将梯度量的样品分别涂在LSEC细胞和HepG2细胞上,结果如图5a-b所示。进一步观察红细胞形,MCH4组红细胞保持与正常红细胞相似的双凹和圆饼状(图5d)。此外,将该材料植入小鼠背部和家兔肝叶进行体内生物安全性研究,均未见明显异常的组织病理结构,说明材料没有直接损伤健康组织(图5e-f)。
为了探索MCH4的转化潜力,研究者对暴露于AMF的HepG2细胞进行了体外研究。结果表明:在AMF存在的情况下,MCH4介导的磁热疗可以大大降低肿瘤细胞的活力,从而使进一步的磁热疗消融治疗HCC的临床应用成为可能。

图5 暴露于MCH4的生物相容性和磁热杀伤能力的评价
5. MCH4的体内评价
然后,研究者建立了小鼠皮下肿瘤模型,旨在评估将水凝胶注入肿瘤的磁热消融治疗的有效性(图6a)。瘤内注射后,将小鼠置于铜线圈中心,在15 kA/m的AMF下处理15分钟(图6b)。在此过程中,保留了红外热图像,如图6c所示,并监测了相关的温度变化,其中MS+AMF和MCH4+AMF的肿瘤区域出现了明显的热疗,但PBS+AMF的温度没有明显升高(图6d)。经MCH4+AMF处理后,在研究期间无肿瘤复发的情况下,提高了磁热消融技术的有效性(图6e)。此外,各组小鼠的体重没有明显差异(图6f),相关染色也证实MS+AMF的有效抑制作用,使肿瘤细胞坏死更多,表明其对肿瘤的清除作用成功(图6g-h)。

图6 MCH4对H22荷瘤小鼠模型磁热消融效果的评价
最后,研究者构建了VX2荷瘤兔,探讨水凝胶消融注射治疗原位肝癌的疗效(图7a)。CT影像学评估显示,研究期结束后,位于肝叶的VX2肿瘤已基本被抑制(图7b-d),未经治疗的家兔肝脏显示肿瘤组织清晰。MCH4+AMF治疗组在相对较小的病变区域出现组织凝固(图7e)。茜素红染色显示消融区凝固组织内钙沉积,提示该区域存在钙盐,提示钙化形成(图7f)。

图7 超声引导下,MCH4作为水凝胶热消融剂在兔VX2荷瘤模型中发挥作用
综上,本文报道了一种新的胶体水凝胶热消融剂,它是由明胶NPs和Fe3O4 NPs通过pH介导凝胶化而成,可以快速、方便地注射,满足临床微创植入的需要,并且在AMF下具有磁致加热性能,可以进一步对肝癌进行热消融治疗。所制备的水凝胶具有良好的生物相容性和明显的细胞毒性。除光热疗法外,这种热疗的诱导不受人体深度渗透的限制。在体内实验中,该材料对H22荷瘤小鼠显示出相当的治疗效果,超声引导下将其用于VX2荷瘤兔模型深部实体肝癌(HCC),结果表明其具有消除局部病变的能力。总的来说,本文提出的策略,结合微创经皮介入和额外的磁热消融,是HCC治疗的重要一步,可以避免正常组织的生物安全风险和高磁场强度(或长时间消融)造成的附带损害。
了解更多
关注“EngineeringForLife”,了解更多前沿科研资讯~
