或许在不久的将来,干细胞疗法真的会开启人类治疗脊髓损伤的新时代!
撰文:Yang Jiayin
首发:干细胞者说
● ● ●脊髓损伤(Spinal cord injury),通常指脊髓受到外部影响,造成损伤部位及其以下部分瘫痪或全部瘫痪,使患者终身残疾。脊髓损伤是一种比较常见的外伤。
长期以来,治疗脊髓损伤主要通过手术脊髓减压恢复其稳定性,通过药物、高压氧等治疗来抑制或减轻其继发性损伤。在一定程度上减轻了患者症状,但并未在神经功能方面取得根本的改变。因此,当今急需一种高效安全的治疗方案来改变这种状况。

脊髓损伤(源自bing)
于是,干细胞治疗应运而生。脊髓损伤治疗的难点在于:神经传导重建及运动功能的恢复。免疫系统一方面是可促进神经系统的再生,而另一方面却产生瘢痕阻止神经再生连接。一般认为治疗窗口期为 6 个月。1
曙光初现的干细胞疗法
干细胞由于具有强大的自我复制能力和旁分泌作用,科学家和医生对其在治疗“脊髓损伤”方面寄予了很大希望。关于机理,越来越多的证据表明可能有两种:
移植后的细胞通过提供修复损伤的细胞因子,促进原受损组织自然修复,或防止损伤进一步加重。
移植细胞替代受损细胞<如神经元和少突胶质细胞等>,促进脊髓损伤空洞区形成桥接,引导神经再生、调节免疫微环境、修复脊髓中非神经组织等促进神经损伤恢复。目前全球在研的干细胞治疗脊髓损伤临床试验项目,使用了骨髓间充质干细胞、脂肪干细胞、脐带间充质干细胞、神经细胞、少突胶质前体细胞、自体施旺细胞、自体嗅鞘细胞。根据美国国立卫生研究院(NIH)全球最大的临床研究数据库ClinicalTrials上注册的信息统计,细胞治疗脊髓损伤临床试验项目有57项,其中大部分处在1期,有些处在2期。

表1. 用于治疗脊髓损伤细胞种类来源
2用于治疗脊髓损伤的细胞疗法临床试验中,最常见用于治疗脊髓损伤的细胞来源主要是间充质干细胞、神经干细胞和少突胶质前体细胞。

间充质干细胞
间充质干细胞(Mesenchymal Stem Cells, MSCs),通常来源骨髓、脂肪组织、脐带、胎盘等组织。间充质干细胞易于分离和扩增,具有免疫调节、抗凋亡、血管生成、抗瘢痕和营养支持等多种生物学功能。
临床试验中,最常用于治疗脊髓损伤的细胞来源,当属间充质干细胞。据统计,间充质干细胞治疗脊髓损伤,临床结果显示无明显副作用,并有一定的治疗效果[2-4]。
2015年,中科院遗传所戴建武团队,开展世界首例神经再生胶原支架结合骨髓单个核细胞(里面含BMSC)移植治疗脊髓损伤的临床研究。先后在3家临床医院进行了5例脊髓损伤修复手术,安全性得到肯定。除了干细胞作用,神经再生胶原支架功不可没,避免了细胞的扩散,提高了干细胞治疗效果。2017年,中山大学附属第三医院戎利民团队开展间充质干细胞治疗脊髓损伤。目前,戎利民团队负责 “鞘内注射人同种异体脐带间充质干细胞治疗脊髓损伤的临床试验及机制研究”项目。他们发布了干细胞治疗早慢性脊髓损伤的临床研究方案[5-6],并开展了超过百例的临床试验。2019年,日本有条件地批准上市了一款治疗脊髓损伤的间充质干细胞疗法——Stemirac。首先抽取患者约50 ml骨髓血,并获得间充质干细胞,再体外扩增至5千万到2亿数量,在损伤发生后的3-8周内将其静脉注射到患者体内,以期达到治疗效果。神经干细胞
神经干细胞(Neural Stem Cells,NSC),是神经系统内的干细胞,可自我更新并演变为分化的前体细胞,从而生成神经元及胶质细胞,比如星形胶质细胞和少突胶质细胞。
1992年,Reynolds和Weiss等首先从小鼠纹状体中分离获得神经干细胞。神经干细胞的发现为脊髓损伤治疗带来新的希望,移植的神经干细胞可填充脊髓损伤后残留的空腔,在体内分化出神经元、星形胶质细胞和少突胶质细胞,提供再髓鞘化及新的神经连接,保持神经纤维的完整性。
Stem Cells Inc.是国际上首个开展神经干细胞(来自流产胎脑组织)治疗脊髓损伤的公司,部分病人的感觉功能有所改善。然而,Stem Cells Inc.2016年5月由于某些原因终止了干细胞治疗脊髓损伤 2 期临床试验。
神经干细胞,也可以通过诱导多能干细胞(iPSCs)分化获得。目前,日本庆应大学正在开展iPSC来源的神经干细胞治疗脊髓损伤,观察其安全性和有效性,为期一年。与天然获得的神经干细胞相比,iPSCs来源的神经干细胞具有可批量生产,自体移植的优势[7]。
少突胶质前体细胞
少突胶质细胞(Oligodendrocyte,OL),是中枢神经的成髓鞘神经胶质细胞,而OPC是少突胶质细胞系发育的起始细胞,是未成熟的OL,有较强的增殖能力。OPC可以在体内增殖、迁移、分化为成熟的少突胶质细胞,并形成髓鞘发挥功能。OPC适用于脊髓损伤治疗,对损伤反应迅速,能自我更新,是损伤修复的重要组成部分。
动物实验表明,移植的OPC可促进白质存留,增加内源性少突胶质细胞数量,减小空腔容积,从而提高运动恢复。OPC其潜在的治疗机制可能是,再髓鞘化,调节局部免疫微环境,分泌神经营养因子,提供物理支架以支撑生长的轴突。OPC可以分泌一系列物质,包括生长因子,神经营养因子,趋化因子与细胞因子。
OPC治疗脊髓损伤究竟是因为分泌功能,还是因为髓鞘再生功能,至今尚未明确。由于原代OPC获取较为困难,其来源问题仍是其应用于临床需要解决的问题之一。
多能干细胞(PSC),包括胚胎干细胞(ESC)和诱导性多能干细胞( iPSC),通过定向分化可获得大量的OPC。多能干细胞可在体外无限扩增,具有很强的分化潜能,理论上可形成体内任何一种细胞。2009年,美国FDA批准一项临床试验,利用胚胎干细胞分化获得的OPC细胞治疗脊髓损伤。后期因为财务原因该项目终止。
Asterias Biotherapeutics公司继续开展进行一项针对脊髓损伤的干细胞治疗临床试验。这个疗法的核心部分是AST-OPC1,一种由人胚胎干细胞分化而来的OPC。1/2a临床试验表明,AST-OPC1具有良好的安全性,且可以提升病人运动能力。不过OPC1 作为胚胎干细胞的来源的细胞,需要考虑免疫排斥问题。
2020年,国内干细胞企业三启生物及其全资子公司三启药物开发了一种转分化方法(PCT/CN2014/087828),可利用小分子化合物,将人成纤维细胞为OPCs。其优势在于自体无排异,转化效率高,也具有一定的成本优势。遗憾的是,目前还不能规模化生产。这种方法有望开发一种基于自体OPC的脊髓损伤创新疗法。
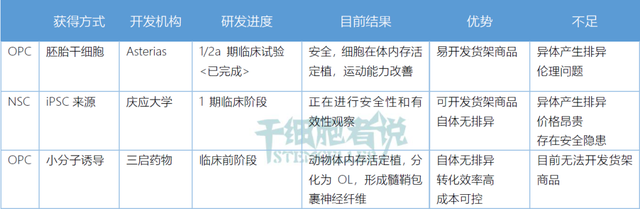
表3. 基于OPC的脊髓损伤创新疗法
3
文末小结
干细胞治疗脊髓损伤的探索脚步从未停止,如何让干细胞疗法更安全有效应用于脊髓损伤,这是科学家们和细胞疗法开发企业正在做的事情。
对于所有脊髓损伤患者来说,每一项有意义的临床试验进展,不管是一小步还是一大步,都将改变他们人生的脚步。
参考文献
[1] Ahuja, C.S., etal., The leading edge: Emergingneuroprotective and neuroregenerative cell-based therapies for spinal cordinjury. Stem Cells Transl Med, 2020. 9(12):p. 1509-1530.
[2] Park, J.H., etal., Long-term results of spinal cordinjury therapy using mesenchymal stem cells derived from bone marrow in humans. Neurosurgery, 2012. 70(5): p.1238-47; discussion 1247.
[3] Lee, S.H., et al.,Impact of local injection ofbrain-derived neurotrophic factor-expressing mesenchymal stromal cells (MSCs)combined with intravenous MSC delivery in a canine model of chronic spinal cordinjury. Cytotherapy, 2016.
[4]Jarocha, D., etal., Continuous improvement aftermultiple mesenchymal stem cell transplantations in a patient with completespinal cord injury. Cell Transplant, 2015. 24(4): p. 661-72.
[5] Yang, Y., et al., Subarachnoid transplantation of humanumbilical cord mesenchymal stem cell in rodent model with subacute incompletespinal cord injury: Preclinical safety and efficacy study. Exp Cell Res,2020. 395(2): p. 112184.
[6] Yang, Y., et al., Human umbilical cord mesenchymal stem cellsto treat spinal cord injury in the early chronic phase: study protocol for aprospective, multicenter, randomized, placebo-controlled, single-blindedclinical trial. Neural Regen Res, 2020. 15(8): p. 1532-1538.
[7] Yamanaka, S., Pluripotent Stem Cell-Based CellTherapy-Promise and Challenges. Cell Stem Cell, 2020. 27(4): p. 523-531.

— END —

- 科普 情怀 责任 -
