

APTT:
1.内源性凝血途径的相关蛋白(XII因子、前激肽释放酶PK、高分子量激肽原HK、XI、IX、VIII因子)
2.共同路径的蛋白(X、V、II和纤维蛋白原)。
3.正常参考值:24-36秒,反应内源性凝血途径,凝血因子Ⅷ、Ⅸ、Ⅺ、Ⅻ、Ⅱ、Ⅴ、Ⅹ及纤维蛋白原减少,肝素使用,纤维蛋白原降解产物增多,DIC会导致延长。使用肝素需要监测。
PT:
1.外源性凝血途径的蛋白(VIIa、组织因子);
2.共同路径的蛋白(X、V、II和纤维蛋白原)
3.正常参考值:12-16秒,反应外源性凝血途径以及口服抗凝药剂量(比如华法林)控制参考指标。严重肝损伤导致的凝血酶原及各凝血因子生成障碍、维生素K不足(凝血酶原、Ⅶ、Ⅸ、Ⅹ因子合成需VitK,华法林和一些灭鼠药属于维生素K拮抗剂)、大量凝血因子消耗(DIC等)会导致PT时间延长。机体高凝状态时间会缩短。同一份血液在不同的实验室,用不同的ISI试剂检测,PT值结果差异很大,但测的INR值(正常参考值:0.8-1.5)相同,所以INR的参考意义比PT更大,其实就是一个全球统一的可以换算的标准,这也是为什么临床上口服抗凝药物主要参考INR。
TT
评估的是纤维蛋白原的功能,纤维蛋白原降低或异常都会导致TT延长。反映纤维蛋白原转为纤维蛋白的时间,类肝素物质增多、抗凝血酶Ⅲ活性增高、纤维蛋白原异常导致延长。
Fib
增高:急性时相反应蛋白,为冠心病和脑血管病独立危险因素
降低:肝病、药物、遗传
正常参考值:2—4g/L,很多疾病如感染、肿瘤都会导致它升高(因为它不仅是一种凝血因子,同时也是一种急性时相反应蛋白),减少见于大出血、先天纤维蛋白原异常、DIC和严重肝脏疾病。
DD
1.血栓前状态与血栓性疾病的诊断:
活动性深静脉血栓形成与肺栓塞时,D-D显者升高,若D-D〈0.5mg/L,发生急性或活动性血栓形成的可能性较小。
2.继发性与纤溶亢进症的鉴别诊断
FDP
纤维蛋白(原)降解产物测定主要反映是否存在纤溶亢进的临床现象或疾病
抗凝血酶III:反应出血和高凝状态
1、活性增高:见于血友病,口服抗凝剂等。
2、活性降低:见于DIC、肝病、术后、心肌梗塞、心绞痛、脑血管疾病、肾病(从尿中丢失)、深静脉血栓、反复原因不明的血栓形成、肺梗塞、妊高症等疾病。
凝血级联反应凝血因子的名字:
因子I,纤维蛋白原
因子II,凝血酶原(凝血素)
因子III,组织因子(凝血酶原酶)
因子IV,钙因子(Ca2+)
因子V,促凝血球蛋白原,易变因子
因子VII,转变加速因子前体,促凝血酶原激酶原,辅助促凝血酶原激酶
因子VIII,抗血友病球蛋白A(AHG A),抗血友病因子A(AHF A),血小板辅助因子I,血友病因子VIII或A
因子IX,抗血友病球蛋白B(AHG B),抗血友病因子B(AHF B),血友病因子IX或B
因子X,STUART(-PROWER)-F,自体凝血酶原C
因子XI,ROSENTHAL因子,抗血友病球蛋白C
因子XII,HAGEMAN因子,表面因子
因子XIII,纤维蛋白稳定因子
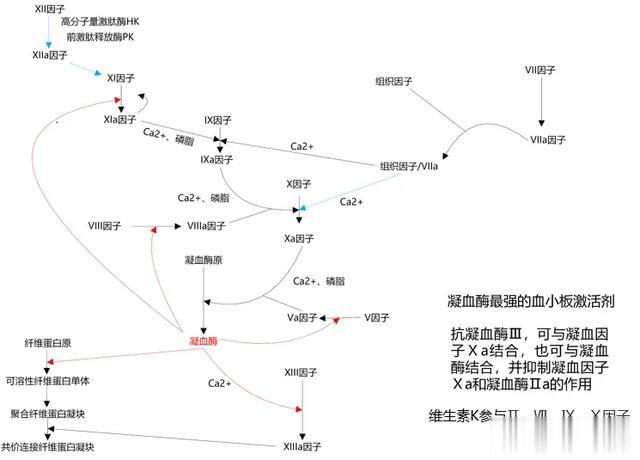

启动:外源性凝血途径——纤维蛋白的形成
血管受损后组织因子就跑出来找VII因子了,在钙离子等人的帮助下VII因子就变成VIIa因子,然后诱导X因子变成Xa因子,在钙离子和磷脂等人的帮助下新形成的Xa因子和Va因子结合形成凝血酶原酶,将凝血酶原变成凝血酶,然后将纤维蛋白原变成纤维蛋白,随后在钙离子帮助下促使XIII因子变成XIIIa因子,形成纤维蛋白凝块。
如果血管受损后组织因子释放量不足(比如小伤),则最开始参与外源性凝血途径的X因子则会被IX因子取代,随后IXa因子在钙离子和磷脂的作用下形成VIIIa因子,再进一步激活X因子。(VIII因子缺乏导致血友病A,IX因子缺乏导致血友病B,因LACI和EPI的存在外源性凝血途径存在时间很短,主要阻断的是VIIa因子至X因子这一段,但是却不能阻断IX因子这一途径)。

维持:
内源性凝血途径从XI因子开始,在凝血酶(没错这就是外源性凝血途径的产物)的作用下XI因子活化为XIa,在钙离子的帮助下XIa活化IX为IXa。
凝血酶还会通过活化V因子和VIII因子进一步刺激内源性凝血途径,这一过程不需要钙离子和磷脂的参与。
因为外源性凝血途径存在时间很短,所以接下来主要依靠内源性凝血途径维持凝血级联反应。凝血总是从外源性的那一支开始(组织因子和VIIa结合),得到最终的产物---纤维蛋白fibrin后,外源性的这一支就关闭了。
当纤维蛋白形成的时候纤维蛋白溶解就在纤溶酶的作用下开始了。

调节:
抗凝血酶III可以阻断凝血酶、IXa因子、Xa因子、XIa因子活性,但是抗凝血酶III作用缓慢,如果合用肝素,则抗凝血酶III的作用迅速会完成。因此单独的肝素不起作用,单独的抗凝血酶III则作用缓慢,这两者结合则迅速完成抗凝作用,而一旦完成了抑制凝血的作用,肝素则又单独分离出来回到最开始的位置再和抗凝血酶III结合。普通肝素可以作用于凝血过程中的多个因子,但最主要的是增强抗凝血酶III的活性,来灭活X因子与凝血酶。随着肝素的分子量减小,低分子肝素、磺达肝葵钠等则对X因子的灭活要远强于凝血酶原II因子,所以这个时候可以不检测APTT。
蛋白C(维生素K依赖性蛋白)能够使Va因子和VIIIa因子失活。

DIC的诊断标准:


DIC鉴别及治疗
弥散性血管内凝血(DIC)是一种以全身凝血系统激活为特征的疾病,可导致中小型血管血栓阻塞,从而导致器官功能障碍。同时,血小板和凝血因子的持续消耗会导致血小板和凝血因子降低,导致大出血。此外,高水平的纤维蛋白降解产物会影响血小板功能和纤维蛋白交联,从而进一步导致出血。
但是,DIC本身并不是一种疾病,而是继发于导致凝血系统激活的其他潜在疾病。
约35%的严重脓毒症患者会并发弥漫性血管内凝血(DIC),DIC更常见于G-菌感染患者。
鉴别:
1.脓毒症本身会引起血小板减少,主要原因是血小板生成受损、消耗或破坏增加,以及血小板在脾或内皮细胞表面的扣留,同时脓毒症患者还会出现吞噬血细胞现象。脓毒症时,血管表面也可能发生血小板的激活、消耗和破坏,这是广泛的内皮细胞-血小板相互作用的结果。但是一般不会导致凝血时间的明显延长。
2.血栓性血小板减少性紫癜或溶血性尿毒症综合征凝血时间一般正常,同时D-二聚体会轻微升高。需注意的是,严重脓毒症和DIC患者的ADAMTS-13水平也会降低(原因可能与紊乱的内皮细胞释放大量von Willebrand因子多聚体所致),所以DIC和血栓性微血管病变之间会有一定程度的重叠。
3.肝素诱导的血小板减少症(HIT)通常不会导致凝血时间异常。
4.严重肝功能衰竭的患者,因血小板会在增大的脾中扣留,同时血小板生成素水平降低,会导致血小板降低。而且血浆中几乎所有凝血因子(除VIII因子和血管性血友病因子)都与肝脏有关。因此血小板减少和低水平凝血因子会导致出血高风险。但是慢性肝衰竭患者的止血系统会得到重新平衡,低水平的天然凝血抑制剂可以平衡低水平的凝血因子,血小板的降低可被高水平的von Willebrand因子所平衡。与DIC患者相比,严重肝病中血小板计数即使下降也通常是稳定的,由于纤溶激活和损害同时存在,纤维蛋白降解产物(如D-二聚体)仅轻度升高。此外,脾肿大和腹水的存在更倾向于肝病。


维生素K可以纠正维生素K依赖性因子,在用药后4到6小时内起作用。
创伤性凝血病:
创伤后最常见的死亡原因是出血和创伤性颅脑损伤(TBI)。创伤性凝血病(Trauma‐induced coagulopathy,TIC)的治疗在这两方面都有重要意义。
创伤后出血存在两种机制:血管损伤引起的解剖性出血和凝血反应引起的出血。
大多数创伤后出血是非凝固性的,而凝固性出血很少见,即使在毛细血管床的水平上也不能形成止血凝块,导致未损伤部位的弥漫性出血,极难通过机械干预来阻止。
大约1/4-1/3的创伤患者存在创伤性凝血病(Trauma‐induced coagulopathy,TIC),其特征是凝血块形成和分解障碍以及整体血管稳态的受损。
激活蛋白C(APC)被认为是TIC的主要发病机制。

完整的内皮具有抗血栓作用,这一特性是由几种介质维持的,包括组织因子途径抑制物、内皮蛋白C受体、内皮糖萼层(EGL)、血栓调节蛋白、一氧化氮和组织型纤溶酶原激活剂。
创伤可以激活神经体液系统,导致儿茶酚胺激增。儿茶酚胺水平的增加导致内皮损伤和糖萼降解,即内皮病。
创伤后的热量损失、产热减少和输液会导致低体温。当核心体温低于33℃时,血小板功能和凝血因子活性显著降低。代谢性酸中毒会导致凝血因子活性降低。酸中毒加速了纤维蛋白原的消耗,却不会影响纤维蛋白原的产生,此时给予碳酸氢钠纠正酸中毒并不能逆转这种凝血障碍。酸中毒的情况下,很多凝血因子活性降低,凝血的起始过程并无明显变化,但是延长了血栓形成时间并降低血栓强度。此外大量输液也会导致稀释性凝血病。
治疗注意:
1.早期(创伤后3h内)使用氨甲环酸能够降低死亡风险。
2.新鲜冰冻血浆(FFP)是一种比晶体液更好的容量替代物,却不能有效的纠正凝血障碍。
3.血小板计数并不能代表血小板功能,此时血小板功能往往受损,但是此时输注血小板不能逆转血小板功能,也不能改善脑损伤患者的预后,甚至可能增加患者死亡率。


 脓毒症相关凝血病
脓毒症相关凝血病诊断标准

当总分≥4分,凝血酶原时间和凝血功能总分>2分(≥3)时,诊断为脓毒症所致凝血障碍。SOFA总分定义为2,大于等于2分最终得分都为2.

(SIC分值及28天死亡率)
脓毒症相关凝血障碍(SIC)评分是一个三变量评分系统,旨在识别可能患有SIC的脓毒症患者,并告知临床医生与每次评分增加相关的死亡率值。这是一个修订后的评分系统,纳入了Sepsis III数据集的新数据。研究人员检查了一系列血液学参数,并通过Logistic回归分析确定血小板计数、INR和SOFA评分可以独立预测死亡率。SIC总评分为4或更高则提示存在SIC,尽管血小板和INR的贡献值必须至少为3。理由是达到该阈值的死亡率急剧上升,这已在多项验证研究中重现。这项工作的局限性是,在衍生性研究中,所有患者都接受了重组血栓调节蛋白的治疗,这可能影响了28天的死亡率。研究作者建议,那些SIC评分较高的患者应评估是否存在DIC。
发病机制

脓毒症相关性凝血障碍的发病机制:凝血酶是激活内皮细胞和血小板的关键介质。凝血酶与蛋白酶激活受体1(PAR1)结合,诱导炎症反应、血栓前改变,并激活血小板聚集。受损的内皮细胞会释放血管生成素2(Ang2),通过Tie2受体-血管紧张素2受体(ACE2)抵消血管生成素1的抗炎作用。血管生成素2还会增加血管通透性,引起抗凝蛋白的丢失。脓毒症时血管内皮细胞表面血管紧张素转换酶2(ACE2)活性降低,血管紧张素II(Ang II)水平升高,引起血管收缩和炎症反应。

脓毒症相关性凝血障碍的发病机制。巨噬细胞通过病原体识别受体(PRRs)识别病原体入侵,并在其表面表达组织因子(TF),启动凝血级联反应。脓毒症时巨噬细胞也会释放促炎细胞因子和微泡。激活的中性粒细胞释放中性粒细胞胞外陷阱(Nets)和细胞毒性介质,比如溶酶体和氧自由基,从而破坏内皮细胞。内皮细胞失去糖萼而失去抗凝特性,并减少一氧化氮(NO)、前列腺素I2(PG I2)和组织因子途径抑制物(TAFI)的释放。受损的内皮细胞产生纤溶酶原激活物抑制物1,释放VWF,表达粘附分子。补体系统被激活,促凝血剂C3a-5a增加,膜攻击复合物(MAC)损伤内皮细胞。受损的细胞释放损伤相关因子,如无细胞DNA、组蛋白和高迁移率族蛋白1(HMGB1),并加速血栓的形成。
整理by唐坤 昆医附一院
