提到CAR-T疗法,大家想必都熟知这位2021年突然爆火的细胞免疫界的“顶流”。CAR-T当时是以治愈癌症为目标,在血液性肿瘤的治疗中,其有效率甚至超过80%,一度成为最耀眼的明星疗法,这也让CAR-T的发明者Carl June教授被冠以“CAR-T之父”之名。
然而,CAR-T治疗在实体瘤上的临床疗效差强人意。究其原因,主要在于实体瘤的细胞疗法存在不少难点,如不同类型实体瘤的异质性大、缺乏独特的肿瘤相关抗原作为CAR-T靶点、T细胞无法有效归巢到肿瘤部位、CAR-T细胞持续性不够以及肿瘤内复杂的微环境对免疫有抑制作用。
在血液肿瘤方面,CAR-T疗法面临的挑战主要在癌症能否长期缓解上,尤其是如何延长CAR-T细胞的寿命,降低癌症复发。
为了克服CAR-T疗法的这些短板,近日,有“CAR-T之父”之称的Carl June博士在著名医学期刊《Cancer Cell》上对在临床试验阶段的不同CAR-T联合治疗策略进行全面概括,旨在将CAR-T细胞与其他现有疗法相结合,以寻求增强CAR-T疗效、减轻毒性、扩大治疗范围的全新联合疗法。

图源截自《Cancer Cell》官网
今天,无癌家园小编就大致介绍下CAR-T细胞联合疗法治疗癌症的相关临床研究,以给癌友们提供更多治疗思路及选择。
靶向免疫检查点的抗体联合CAR-T
这项联合疗法的策略是在于靶向PD-1和PD-L1的单克隆抗体,可增强肿瘤浸润淋巴细胞(TIL)的功能,恢复它们攻击癌细胞的能力。由此可得,与CAR-T疗法联合治疗时,这些免疫检查点抑制剂能够提高肿瘤微环境内的工程细胞的持久性和疗效。联合治疗这种1+1>2的想法或许是个不错的治疗选择,抗癌就像打群架,一个人干不过就多找几个帮手。无癌家园小编下面举一些典型的临床研究结果以供各位参考。
1年存活率83%!CAR-T联合PD-1挑战恶性胸膜间皮瘤,疗效惊艳
2021年11月,来自美国的医学研究者们发布了一项CAR-T联合PD-1抑制剂的临床试验的I期结果在知名《Cancer Discovery》杂志上,主要阐述了以间皮素为靶点的自体CAR-T细胞与帕博利珠单抗(pembrolizumab,商品名Keytruda)联用治疗恶性胸膜间皮瘤(MPM)的临床疗效。

间皮素是一种肿瘤相关抗原,在上皮样间皮瘤、肺癌、胰腺癌、卵巢癌、乳腺癌、胆管癌和胃癌等多种恶性肿瘤细胞上过表达,而在大多数正常组织中几乎没有表达。由于其与肿瘤的迁移密切相关,因此可作为一个很好的肿瘤治疗相关靶点。
在此项临试验中,共纳入27例患有胸腔肿瘤的患者接受治疗,其中转移性肺腺癌1例,转移性乳腺癌1例,其余均为恶性胸膜间皮瘤患者。
27例患者中,有23例恶性胸膜间皮瘤患者在CAR-T治疗前进行环磷酰胺预处理,其中有18例患者接受CAR-T联合pembrolizumab治疗,5例仅接受CAR-T治疗。值得一提的是,所有患者均接受过一轮既往治疗,33%的患者接受过≥3轮的既往治疗。
需要指出的是,恶性胸膜间皮瘤是一种PD-L1表达及肿瘤突变负荷均较低的恶性肿瘤,前期的临床试验也证明患者不能受益于PD-1/PD-L1免疫抑制剂的单药治疗。
入组的患者从确诊到接受CAR-T治疗平均间隔6.1个月,从CAR-T治疗到开始帕博利珠单抗治疗平均间隔6周。令人惊喜的是,在3×105~6×107/kg的CAR-T剂量范围内,研究人员并没有发现剂量限制性毒性。没有患者出现二级以上细胞因子风暴、神经系统毒性、及脱靶导致的副作用。
在确保安全性和持续性良好的细胞制品的前提下,临床效果也让人格外惊艳!
23例接受治疗的恶性胸膜间皮瘤患者中,CAR-T治疗后的中位生存期为17.7个月,一年存活率为74%。而在18名接受了CAR-T+帕博利珠单抗联合治疗的患者中,中位生存期达到了23.9个月,一年存活率为83%。
更惊人的发现是,靶向间皮素的CAR-T疗法有望在恶性胸膜间皮瘤患者中实现长期的疾病缓解。在治疗后第4~6周的影像检查中(n=16),有12.5%的患者的疗效达到了部分缓解,56.3%的患者为疾病稳定。在疾病稳定或部分缓解的患者中,有8名患者能够维持疾病状态超过6个月。

23例恶性胸膜间皮瘤患者疗程及疗效
目前急招B细胞淋巴瘤、T细胞淋巴瘤、T细胞白血病(T-ALL)、急性淋巴细胞白血病、非霍奇金淋巴瘤、胃癌、胰腺癌、结直肠癌、多发性骨髓瘤等癌种!
评估病情能否能够接受CAR-T疗法可通过无癌家园医学部!
详情请戳:
下图为当前正在进行且正在招募受试者的临床试验示例,这些试验旨在测试不同药物以增强CAR-T细胞疗效,截至2024年4月11日。
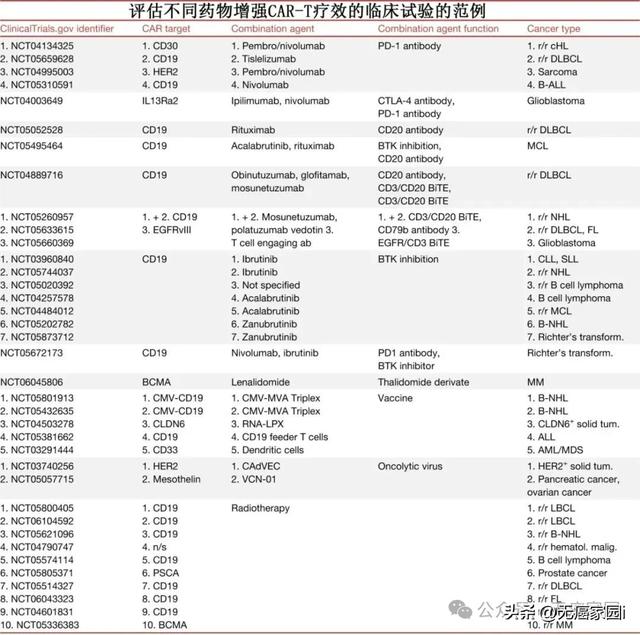
肿瘤靶向抗体和双特异性抗体联合CAR-T
靶向CD20的单克隆抗体利妥昔单抗(Rituximab)和奥妥珠单抗(Obinutuzuma)以及靶向CD3/CD20的双特异性T细胞接合剂(BiTE),例如格罗菲妥单抗(Glofitamab)和莫妥珠单抗(Mosunetuzumab),已被批准用于不同的血液肿瘤,联合使用可增强CAR-T细胞疗效。
客观缓解率88%,CAR-T联合利妥昔单抗狙击复发难治性LBCL!
ZUMA-14研究探索了CAR-T细胞疗法联合利妥昔单抗(靶向CD20的单克隆抗体)在难治性大B细胞淋巴瘤(LBCL)患者中的获益。
尽管axi-cel疗法取得了一定的成功,但约60%的患者在治疗后约2年内无反应或复发。在临床前研究中,利妥昔单抗(Rtx)增强了CD19 CAR T细胞的功能,并通过与CAR T细胞的协同靶向作用增加了肿瘤减退和小鼠模型中的生存率。
截至2021年12月2日,共招募了27例患者,26例患者接受了axi-cel和至少一剂利妥昔单抗(15例患者接受了全部6剂利妥昔单抗)。结果显示,完全缓解率为65%,客观缓解率为88%。在中位随访17个月期间,65%的患者持续缓解,其中57%的患者持续完全缓解。
ZUMA-14的结果表明,axi-cel联合利妥昔单抗在R-LBCL患者中达到了较高的完全缓解率,且安全性较高。
小分子药物联合CAR-T
除了抗体外,还有几种小分子药物已获批用于治疗血液癌症和实体瘤,其中一些与CAR-T联合使用的临床试验正在进行中。
布鲁顿酪氨酸激酶(BTK)抑制剂——伊布替尼(ibrutinib)
伊布替尼(Ibrutinib)是一种用于不同B细胞淋巴瘤的布鲁顿酪氨酸激酶(BTK)不可逆抑制剂,是与CAR-T细胞联合临床开发中最先进的小分子药物。
一项涉及19例复发或难治性CLL患者的试点研究表明,使用伊布替尼联合CD19-CAR-T细胞实现了83%的应答率和61%的MRD阴性骨髓反应,与单独的CAR-T细胞治疗相比,联合治疗组的细胞因子释放综合征(CRS)的严重程度有所降低。
近期的一项2期临床试验对接受伊布替尼治疗后未完全起效的CLL患者添加使用CD19-CAR T细胞,并取得良好的结果。72%的患者在一年后未检测到疾病,48个月时的总生存率高达84%。
靶向蛋白质降解剂——来那度胺(lenalidomide)
来那度胺(Lenalidomide)是一种靶向蛋白质降解剂,目前已用于治疗多发性骨髓瘤(MM)等血液系统恶性肿瘤。临床前研究表明,来那度胺可提高CAR-T细胞的疗效,特别是通过增加IFNγ的产生、增强细胞毒性作用、提高肿瘤小鼠存活率。
一项涉及10例高危、新诊断的多发性骨髓瘤(MM)患者的早期临床试验中,依次输注抗CD19和抗BCMA的CAR-T细胞,然后在自体干细胞移植后进行来那度胺维持治疗,耐受性良好,总缓解率高达100%,其中70%的患者维持微小残留病变阴性状态超过2年。
其他疗法联合CAR-T
此外,文章还介绍了癌症疫苗、溶瘤病毒(OV)疗法、放射性疗法分别与CAR-T疗法联合使用的治疗策略在临床试验阶段的进展。
肿瘤病灶完全缓解,mRNA疫苗联合CAR-T狙击实体瘤
BioNTech公司开发的BNT211是靶向实体瘤的新一代CAR-T疗法。它将靶向CLDN6抗原的CAR-T疗法与表达CLDN6抗原的mRNA疫苗CARVac(这是一种独特的CAR-T细胞扩增mRNA疫苗)相结合。
在2023年美国临床肿瘤学会(ASCO)会议上,研究人员更新了关于CLDN6 导向的 CAR-T 细胞疗法 BNT211 无论是否添加 CLDN6 编码 mRNA 疫苗 (CARVac)治疗CLDN6 阳性复发/难治性实体瘤患者的1/2a 期试验结果,显示出令人鼓舞的活动迹象和可控的安全性。

图源来自OnClive官网
数据截止到2023年3月10日,在 17 例接受 BNT211 联合或不联合 CARVac 治疗的可评估患者中,总客观缓解率(ORR)为 41%,疾病控制率(DCR)为65%。
1 名接受治疗的睾丸癌患者获得了手术完全缓解。还有5例患者达到部分缓解(PR),其中 4 例为卵巢癌患者,1 例为其他肿瘤类型。此外,3名患者达到病情稳定(SD)。
此外,手动BNT211 队列的数据也进行了更新。
在2022年ESMO大会上公布的数据显示,共纳入了22例患者(其中21例患者可评估疗效)。肿瘤指征包括睾丸癌(n=13)、卵巢癌(n=4)、子宫内膜癌(n=1)、输卵管癌(n=1)、肉瘤(n=1)、胃癌(n=1)和1例肿瘤原发不明。
截止2022年8月16日,对21例可评估患者的疗效评估显示,最佳总缓解率 为 33%,疾病控制率为 67%,其中1例完全缓解(CR)、6例部分缓解(PR)和7例患者病情稳定(SD)。这意味着,超过60%的患者病情控制稳定或显著缩小30%以上,甚至完全消失!
更新数据显示:截至2023年3月10日,在13例生殖细胞肿瘤患者中有3例患者有持续的临床获益。其中1例幸运的患者在单独使用 BNT211 时获得持续完全缓解(CR)。
在收集研究数据时,1例先前接受过六线化疗的睾丸癌患者仍处于持续的完全缓解状态。研究人员指出,这是一例基线时肿瘤块较大的患者,在CAR-T细胞治疗6周后显示出令人印象深刻的肿瘤消退,仅12周,肺部的转移灶全部消失,评效达到完全缓解的状态。

睾丸癌典型患者治疗情况
综上,BNT211临床试验结果初步证实,CLDN6 CAR-T细胞联合CAR-T的RNA疫苗(CARVac)在剂量探索阶段显示出良好的安全性,并显示出令人鼓舞的疗效。mRNA疫苗(CARVac)可用于改善CAR-T细胞的抗肿瘤作用,为利用CAR-T细胞治疗难治性实体瘤提供了一种新的策略。
对实体瘤重磅出击!溶瘤病毒联手CAR-T疗法,疗效势不可挡!
一项2020年9月2日发表于国外知名杂志《Science Translational Medicine》上的临床研究结果,对此进行了大胆的尝试!
在这项新的研究中,研究人员将两种强效的免疫疗法---溶瘤病毒(oncolytic virus)和嵌合抗原受体T细胞(CAR-T)疗法结合起来,成功地靶向和根除单独用CAR-T细胞疗法很难治疗的实体瘤。

在此临床试验的临床前研究中,研究人员们早已通过对溶瘤病毒进行基因改造,使之进入肿瘤细胞,并诱导它们在肿瘤细胞表面上表达CD19蛋白。然后,他们能够使用靶向CD19的CAR-T细胞来识别和攻击这些实体瘤。
参与这项研究的Saul Priceman博士说:“此研究表明溶瘤病毒是一种强大而有前途的方法,可以与CAR-T细胞疗法战略性地结合起来,以便更有效地靶向实体瘤。两者的结合有强大的协同效果。”
这项临床试验将首先在实体瘤患者中测试OV19t的安全性。如果发现这是安全有效的,那么就可以依次测试溶瘤病毒和CAR-T细胞疗法。该临床试验预计将于近期开始。
此外,放射性治疗因其在不同肿瘤类型中的广泛适用性、无创性以及消除肿瘤细胞的功效而受到重视。在一项针对复发性或难治性弥漫大B细胞淋巴瘤(DLBCL)的CAR-T疗法2期临床试验中,在CAR-T细胞治疗之前接受放疗的患者实现了100%的反应率。这一结果表明,放射性治疗可以作为CAR-T治疗前的减瘤和桥接方案,以及复发后挽救治疗的可行选择。
天价≠神药!CAR-T疗法虽好,但要理性看待!
CAR-T疗法作为新型细胞疗法,近年来在全球癌症细胞免疫治疗领域,可谓是独占鳌头。
但是面对CAR-T疗法,大家还需要保持清醒,理性看待!的确有一部分晚期癌症患者采用CAR-T疗法逆转命运。但它并非万能神药,在实体瘤的治疗上依然充满挑战。
而且与其他的抗癌药一样,CAR-T疗法也有其副作用,例如细胞因子风暴、神经毒性、B细胞终身缺失等,但目前已经有很好的控制方法,能够较好地应对。
因此,基于不菲的价格和副作用,通常CAR-T疗法被用于标准治疗失败(手术、放疗、化疗、靶向治疗、PD-1治疗等)的复发难治性患者身上。
2021年我国迎来了细胞免疫治疗的元年,作为先锋的CAR-T疗法,是未来发展方向之一。CAR-T疗法主要在于改造T细胞来使其识别肿瘤细胞的特殊靶点,理论上,可以有无数种针对不同靶点的CAR-T疗法,这意味着蕴含着无限可能。
希望不久的将来,能够在国内外医学科研工作者的努力下,降低细胞疗法毒副作用,降低价格,突破实体瘤的瓶颈,让越来越多的晚期癌症患者获益!
本文为无癌家园原创
