*仅供医学专业人士阅读参考
我们知道,早在阿尔茨海默病(AD)临床症状出现前,大脑中β-淀粉样蛋白(Aβ)和tau蛋白就会出现异常变化。因此,脑脊液中的AD相关蛋白质水平可以作为AD早期诊断的生物标志物。
尽管目前已经有了一些像Aβ42、Aβ42/Aβ40比值、磷酸化tau(p-tau)、总tau(t-tau)这样的AD脑脊液生物标志物,但这些指标还难以全面反映AD的临床状态和进展情况。这就需要进一步探索更多AD脑脊液蛋白质组学变化特征,了解AD病理变化,并构建相关预测模型,以改善AD的早期诊断。
近期,美国圣路易斯华盛顿大学Carlos Cruchaga团队发表了一项重要研究成果。通过对2286名受试者脑脊液样本进行蛋白质组学分析后,他们成功识别出了2029种独立的,与AD有关的蛋白质,其中43%是以前报道过的,57%(1164)都是新发现的。
此外,基于AT生物标志物框架(A代表Aβ,T代表tau蛋白)的蛋白伪轨迹分析显示,这些蛋白在疾病不同阶段会呈现出四种动态变化模式,分别与神经元死亡以及tau蛋白磷酸化、小胶质细胞功能以及内溶酶体功能异常、神经可塑性、小胶质细胞-神经元相互作用(晚期)等关键生物学过程相关。
根据这些发现,研究运用机器学习开发了一种高准确性的AD生物标志物预测模型,可以精准区分AD患者与健康个体(曲线下面积AUC>0.90),并预测AD生物标志物阴性个体(即没有Aβ也没有tau蛋白聚集)未来进展为AD的风险。
研究发表在《神经元》上。

论文首页截图
研究先从四个独立大型AD队列(即Knight阿尔茨海默病研究中心Knight ADRC、FundacióACE阿尔茨海默病研究中心FACE、阿尔茨海默病神经影像学倡议数据库ADNI以及Barcelona-1队列)中纳入了2286名受试者的脑脊液样本数据,然后再根据AT框架中Aβ和tau蛋白的水平分成AD生物标志物阴性组(A-T-)与AD生物标志物阳性组(A+T+,AD患者),最后再比较两组受试者脑脊液中蛋白表达差异情况,并采用三阶段研究设计(发现阶段、验证阶段、元分析),识别出与AD有关的蛋白。
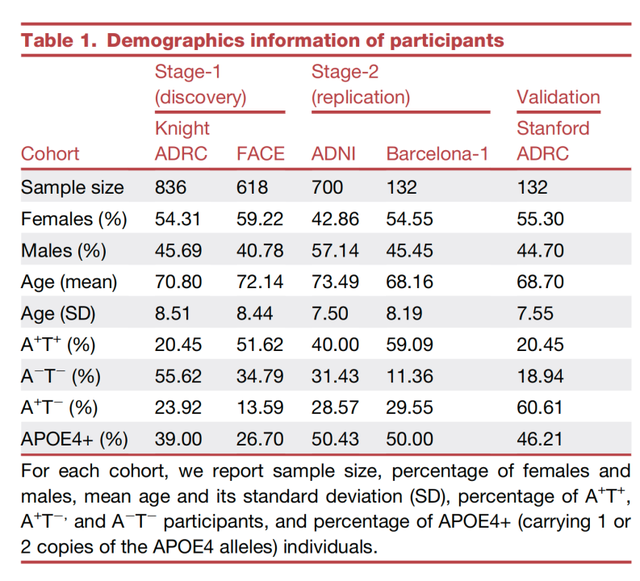

纳入的受试者信息以及三阶段设计流程
结果显示,研究最终成功从脑脊液样本中识别出了2029种与AD显著相关的独立蛋白。通过与其他AD相关蛋白组学研究对比后,研究人员发现,这些蛋白中有43%是以前报道过的,57%(1164)都是新发现的。
此外,研究人员还在独立的AD队列(Stanford ADRC,n=132)中进一步验证了这些蛋白的稳健性。提示,这些蛋白可用于后续的蛋白伪轨迹分析和疾病预测模型构建。

AD相关蛋白识别过程
在AT框架中,根据AD进程,Aβ通常早于tau开始发生变化,因此,AD发生的纵向轨迹可以概括为A-T-、A+T-和A+T+。基于这一框架,研究人员进行了蛋白伪轨迹分析。
结果显示,这些蛋白在疾病不同阶段会呈现出四种动态变化模式。
第一组为呈线性增加模式,在该模式下,有471种蛋白,会在疾病进展过程中持续上升(其中代表性蛋白有SMOC1、NEFL、GFAP、GRN、PPP3R1、SNCA),主要涉及神经元死亡、凋亡,以及tau蛋白磷酸化等病理过程,代表疾病早期阶段。
第二组为先升后降模式,在该模式下,有482种蛋白呈现先上升后下降的趋势(代表性蛋白有LILRB3、TNFAIP3、BTK、SPI1、FLT3、NFKB1、FOXO3),主要涉及小胶质细胞功能异常、免疫炎症反应,以及内溶酶体功能异常等病理过程。
第三组为线性下降模式,在该模式下,有184种蛋白,在整个AD过程中持续下降(代表性蛋白有AXIN2、CTNNB1、SIRT6、CES1、IL-6、FOXO1),主要涉及神经可塑性以及胆固醇代谢等生物学过程(代表失去神经保护机制)。
第四组为先降后升模式,在该模式下,有892种蛋白,在AD早期下降,并在晚期上升(代表性蛋白为CSF1、CSF1R、FAS、IGF1、IGF1R、APOE、TREM2、NRGN),主要涉及小胶质细胞-神经元交互作用以及炎症信号通路等生物学过程(代表炎症激活)。

四种模式
以上结果提示,这些蛋白可以有效反映AD疾病状态。因此,进一步,研究人员想在此基础上构建一个AD生物标志物预测模型。鉴于2029种相关蛋白的数量过大,不适用于临床应用,研究团队使用机器学习筛选出了10种具有最强预测能力的最小蛋白组合,作为AD生物标志物预测模型。
结果发现,该模型对AD具有较高的特异性,不仅能精准区分AD患者与健康个体(独立验证队列AUC=0.97),还能预测AD生物标志物阴性个体未来的AD进展风险(在Knight ADRC和ADNI队列中,AD生物标志物阳性个体在14年内发展为AD的概率显著高于阴性个体)。

模型建立和预测性能
总之,该研究作为迄今为止最大规模的AD脑脊液蛋白组学研究,不仅揭示了AD疾病不同阶段的蛋白变化情况,描述了AD的疾病生物学过程,还成功构建了一个高准确度的AD生物标志物预测模型。这些发现不仅加深了我们对AD蛋白组学和发病机制的理解,还为未来AD生物标志物检测和临床诊断提供了新的方向。
参考文献:
[1]Ali M,Timsina J,Western D,et al.Multi-cohort cerebrospinal fluid proteomics identifies robust molecular signatures across the Alzheimer disease continuum.Neuron.Published online March 12,2025.doi:10.1016/j.neuron.2025.02.014
本文作者丨张金旭
