
 前言
前言硝酸铵(AN)推进剂相较高氯酸铵(AP)推进剂具有很多优势,它的燃烧产物中没有氯化物,无毒且更环保,特性也使得它在安全性方面更出色,对热和冲击不敏感。
但它也有严重的吸湿性,这影响了储存和使用,并可能导致相变,增加了使用上的复杂性。最重要的是,AN的点火和燃烧性能较差,因此无法为高速导弹提供足够的推力。

为了克服这些问题,我们可以使用催化剂来改善AN基推进剂的燃烧性能,使用纳米固体超强酸作为催化剂。这种超级酸酸度远高于常规的液态酸。
它们在许多有机合成反应中作为催化剂已经展现出很大的潜力,因为它们催化性高、选择性高、无污染,并且易于与反应体系分离,可能为改进AN推进剂带来新的契机。
 一、纳米SO制备42−/钛2
一、纳米SO制备42−/钛2为了制备固体超强酸,我们将25%的强氨稀释成浓度为6mol/L的氨溶液,并引入乙醇作为分散剂。再缓慢地将23.75克的TiCl4加入84 mL的氨溶液中,将pH值调节至9∼10,以确保Ti4+完全转换为钛。经过24小时的老化后,用水三次,乙醇两次,丙酮一次对沉淀物进行洗涤。

洗涤后,我们将沉淀物在50°C下进行干燥。干燥后的粉末与玛瑙研钵和无定形TiO的微小颗粒一起进行仔细研磨,并使用超声波搅拌。接着将2克无定形TiO2浸泡在硫酸溶液中,浸渍30分钟后,在80°C下进行干燥。

随后,我们再将干燥后的粉末分别在300°C、400°C、500°C或800°C下进行研磨煅烧,以获得SO42−/钛2超强酸催化剂,研究SO42−/钛2超强酸的催化作用,通过将0.97克AN与0.03克SO42−/钛2仔细手动研磨混合,获得了样品标记为[AN +3%SO42−/钛2]。
为了进行比较,我们需要额外地将0.97克AN与0.03克纳米TiO2仔细手动研磨混合,获得了样品标记为[AN +3%TiO2]。

我们还需要使用发射扫描电子显微镜和透射电子显微镜来观察样品的形貌。这些显微镜能够以极高的分辨率,能显示样品表面的细微结构和内部组织,深入了解物质的微观特性。
再通过照射样品铜K_α辐射,并以40 kV和30 mA的条件进行实验,这样能够获取样品的衍射图谱,进一步探究其晶体结构和相位信息。

而X射线光电子能谱和PHI5000 Versa探针则用于进行XPS分析,这项技术可测量样品表面的化学成分,并提供关于元素的电子能级信息,帮助了解样品的化学组成及其表面特性。
我们也可以运用热分析仪系统与傅里叶变换红外光谱仪的耦合,进行TG-DSC分析和DSC-IR分析。
 二、结果和讨论
二、结果和讨论1 、形态与结构
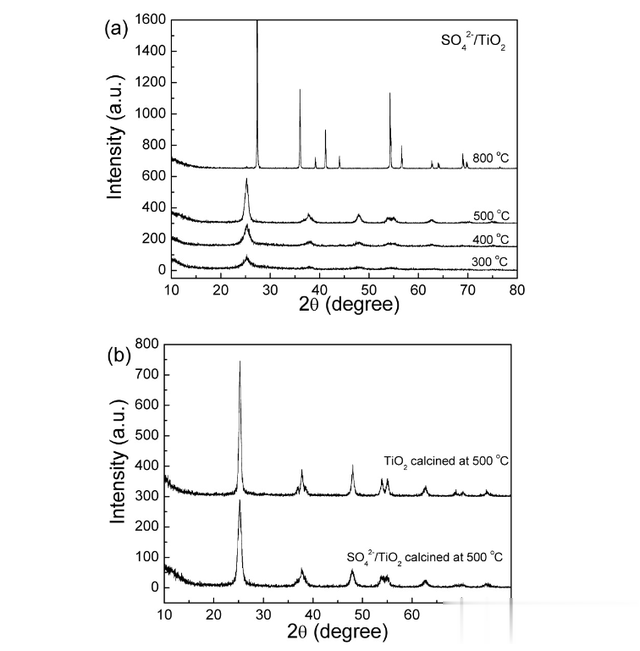
当使用X射线衍射(XRD)分析煅烧粉末时,我们可以了解材料的晶体结构和晶粒尺寸。研究结果显示,非晶态TiO2在300°C、400°C或500°C的煅烧后转化为锐钛矿相TiO2。
随着煅烧温度的升高,XRD衍射峰的强度增加,表明样品的结晶程度逐渐提高。此外,衍射峰呈现宽度现象,这可能意味着晶粒的尺寸在纳米级别。

根据Debye-Scherrer方程(D=Kλ/(βcosθ)),我们能计算得到在500°C下煅烧的锐钛矿相TiO2的平均晶粒尺寸为25.2纳米。
而在更高的煅烧温度800°C下,锐钛矿相TiO2转化为金红石相TiO2,晶粒尺寸超过100纳米。这表明,我们通过调节煅烧温度,可以控制TiO2的结晶程度和晶粒尺寸。
在光谱中检测到三种元素,即硫(S)、钛(Ti)和氧(O)。O和Ti的峰值分别位于529.9电子伏特和458.7电子伏特的结合能处,这些峰应反映了TiO2中的元素存在,因为它们的强度非常高。
另外,结合能为168.5电子伏特处的峰值与硫(S)元素的2p电子跃迁有关。S元素可能源自SO42-,SO42-与钛酸化物反应后固定在TiO2表面。

而对于制备SO42-钛酸盐纳米颗粒,冷冻干燥或超临界干燥可能是更可行的方法。我们可以将粉末加入乙醇中,并使用强超声波来分散团聚的颗粒。

然后,我们还需要对获得的悬浮液进行透射电子显微镜分析,测量并记录每个颗粒的粒径,发现SO42-钛酸盐的平均粒径约为33纳米,稍微小于普通的TiO2颗粒(平均29纳米)。这与XRD分析结果一致,表明表面酸化能略微延缓颗粒的生长。

2、 热分析
TG-DSC技术是一种用于热分析的先进技术。在温度为52.9°C时,AN发生了第一次相变,这个过程伴随着13.9 J/g的热吸收。
而在温度为126.1°C时,AN发生了第二次相变,这次相变的热吸收量为40.1 J/g。尤其是在温度167.6°C处,第三个吸热峰对应着AN的熔化现象,熔化过程释放了55.4 J/g的热量。

在温度范围为239.2°C至277.4°C之间,这是一个最强烈的吸热峰。这个吸热峰表明了AN的分解过程。AN的分解从239.2°C开始,最终在277.4°C达到峰值,整个过程释放了高达888.9 J/g的热量。
理论上,AN的分解过程涉及到液态NH4+无法直接转化为气态NH3(g)和HNO3(g),这是几乎所有洋葱盐的第一个分解步骤。虽然这个解离过程不会自发进行(ΔG = +90.6 kJ mol−1),但只需吸收2.18 kJ/g的热量,它就能发生。

解离后,AN中氧化剂和还原剂之间的氧化还原反应开始释放热量。但由于反应的速率非常低,释放的热量并不明显。因此,在TG-DSC迹线中看到的分解过程是一个吸热的过程。

除此之外,添加纳米催化剂对氨氮(AN)的主要分解过程没有产生明显影响,即使是硫酸根(SO42-)的掺杂,也不能改变这一情况。
在热重差示扫描量热法(DSC)曲线中,我们仍然观察到吸热过程,这意味着纳米催化剂的加入并不能增加反应的热力学效应。

可随着纳米催化剂的添加,氨氮的热分解过程的起始温度(To)和峰值温度(Tp)有所降低。对于钛2氧化物(TiO2)催化剂,其催化作用相对有限,因为相较于纯氨氮,其起始温度仅下降了7.4°C,并且峰值温度几乎没有改变。
相反,硫酸根掺杂的钛2氧化物(SO42- / TiO2),则表现出比TiO2更强的催化作用。其起始温度(To)和峰值温度(Tp)分别下降了19°C和15.8°C。

3、催化机理
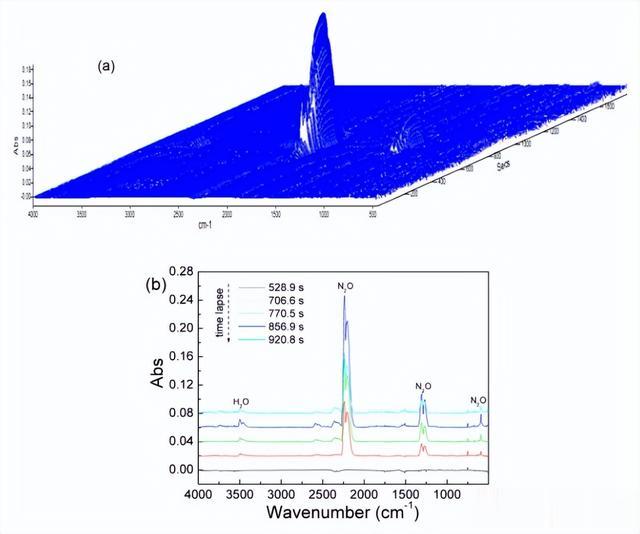
而在使用DSC-IR技术进行检测时,我们发现掺杂了3%SO42−/钛2的硝酸铵在反应中完全进行,但并没有观察到NH3或HNO3的产物。
理论上,硝酸铵的热分解有两种机理:电离反应和自由基反应,这两种机理的最终产物都是N2O,这与实验结果一致。在低温下,分解反应应该根据电离机理进行,因为HO-NO的破裂需要高温(约1300°C)才能发生。
一般来说,这两个反应的速率常数都相对较小,因此它们成为反应的控制步骤。为了促进硝酸铵的分解,需要找到一种加速控制步骤的方法。
在这里,我们可以采用了一种简单的化学过程,基于“强酸可以代替弱酸”的原理。引入了一种酸,“HA”(“H”表示质子;“A”表示阴离子),其酸性由pKα值来量化。
当将HA加入到硝酸铵的分解体系中时,反应NH3+H ⇌ NH+4将发生,前提是pKα(HA)小于pKα。这个过程有助于修复氨气(NH3)并将其转化为无毒的氨根离子(NH+4),从而避免NH3的积累阻碍反应进行。

但如果pKα(HA)小于pKα(HNO3),反应3−+H3O ⇌ HNO+3+H2O 将开始。这个过程会显著增加亚硝酸根离子(HNO3)在反应体系中的浓度,从而加速了控制步骤的进行。
特别是当pKα(HA)远小于pKα(HNO3)时,亚硝酸的分解将发生变化,这对硝酸铵的热解过程至关重要。

当然,在许多化学反应中,也有两种不同类型的酸位点:路易斯酸位点和布朗斯特德酸位点。这些酸位点的存在与S=O基团有关,这个基团对于催化反应具有强大的诱导效应。
最近的研究表明,SO42- /钛2+体系中的质子也发挥了一定的酸性作用。实际上,S=O基团的诱导效应,使得质子成为布朗斯特德酸中心的重要贡献者。
意味着在反应中,表面的酸位点与金属离子密切相关。而且S=O基团的存在可以极大地增强金属离子的酸性强度,进一步推动催化过程。

但在另一个实验中,TiO2却没有展现出催化氨的能力。更奇怪的是,TiO2表面却富含许多路易斯酸位点。以前的一些研究报道称,在某些情况下,路易斯酸位点(在锐钛矿二氧化钛表面)可以催化氨的分解(2NH3→N2+3H2),这个过程在动力学上却非常缓慢。
虽然热力学上氨分解是可行的,但由于反应速率慢,需要高反应温度和贵金属催化剂才能促进这个反应。

而分子H2O在一定条件下,可以通过氨气(AN)的分解来生成并在固体氧化钛(TiO2)表面吸附成氧化物(O42-),这个过程可以启动一种转化过程。然而,液体水也能导致固体氧化钛表面的一些损失,因为水中的硫酸盐基团溶解出来。
所以,在凝聚相(即液态条件下)中,水分子实际上会削弱固体氧化钛的催化效果,从而影响氨气的分解过程。不过,这个因素并不是很重要,因为氨气分解所需的温度超过210°C,此温度下水分子在气态状态而不会影响催化反应。
对于一些无机酸的催化作用研究发现,盐酸的催化能力明显高于硫酸。因此,在使用催化剂时,固体酸可能是一个更好的选择。
而固体超强酸的酸度要比硫酸和盐酸更强,即其pKa值更低(pKa值越低,酸性越强)。举例来说,固体超强酸的pKa值可能小于-12,而硫酸和盐酸的pKa值分别为-3.0和-8.0。
 三、结论
三、结论我们通过采用XRD分析法,确定500°C是纳米固体超强酸(SO42−/钛2)最佳烘烤温度。SEM和TEM分析显示,SO42−/钛2粒子的尺寸约为29纳米。同时,催化剂表面存在着S元素,这一点通过XPS分析得到证实。

结果表明,SO42−/钛2可以有效降低硝酸铵的分解温度约15.8°C,但TiO2并未显示出催化活性。硝酸铵和SO42−/钛2反应生成大量的N2O和几个H2O,而没有NH3在产物中生成。在机理分析中,SO42−/钛2的催化效果是基于强酸代替弱酸的原理提出的。

但由于SO42−/钛2表面的质子具有显著较低的pKa值,导致反应NH3+H⇌NH+4和H3O+HNO3+H2O发生。因此,NH4+离子和氧化态氮在催化剂表面积累,从而促进硝酸铵的分解。
 参考文献
参考文献1、熊晓涛, 刘志林 (2013) 改性石蜡对AN吸湿性的改善.钦. J.推进。36: 50–52.
2、张晓丹, 李建明, 杨瑞军 (2011) 胺类反应性涂覆硝酸铵及其在叠氮聚醚推进剂中的应用研究.J.固体火箭技术。34: 86–91
3、埃里克森 J D (2004) 相稳定的硝酸铵。美国专US20040149363A1。李庆英(2005)固体超强酸酸强度的测定蒸汽法.石油化工技术.4: 75–77
4、詹瑞瑞 (2009) 纳米固体超强酸催化剂SO的研究42−/锆2-首席执行官2-二氧化硅2由稀土改性。中国后方地球。3: 84–88.
5、郭华峰 (2008) 引入Al对固体超强酸SO的影响42−/SnO2.化学物理112: 1065–1068.
