全球每年因创伤、烧伤及外科手术引发的严重软组织损伤病例超千万例,涉及皮肤、肌肉、神经等多种组织。当前临床治疗软组织缺损仍面临组织再生难题——现有疗法多诱导纤维化瘢痕修复,导致功能丧失与外观受损双重困境。在再生医学领域,以水凝胶为代表的生物材料虽展现出促进创面愈合的潜力,却难以突破无瘢痕修复的瓶颈;传统材料在修复过程动态组织适配、免疫响应诱导等关键再生环节仍存在显著局限。
北京航空航天大学生物与医学工程学院、生物力学与力学生物学教育部重点实验室、北京生物医学工程高精尖创新中心樊瑜波教授/侯森助理教授团队创新性地通过液-液相分离精准调控技术,开发出具有连续微孔网络的可注射水凝胶颗粒和基于颗粒的水凝胶支架(PPG),通过微孔结构精准调控实现了伤口无瘢痕愈合,为组织再生提供了全新解决方案(图1)。研究团队通过精密调控胶凝相与成孔相的分离动力学,构建了具有分级微孔结构的可注射水凝胶。这种设计不仅保留了水凝胶的可注射特性,更形成了有利于细胞迁移和血管化的微孔网络。动物实验显示,PPG支架展现出卓越的再生能力,在小鼠模型中通过促进成熟血管网络形成,诱导巨噬细胞向促修复型M2表型极化(M2/M1比值显著升高),激活CD4+Foxp3+调节性T细胞,最终实现含毛囊结构的无瘢痕皮肤再生;在大动物实验中(猪全层皮肤缺损模型),凝胶的细胞浸润效率显著高于临床金标准(胶原/蛋白多糖支架)材料,提高了表皮-真皮整合度和真皮再生质量。相较于传统方法依赖生物活性因子的添加,该技术通过物理拓扑结构调控即可实现组织微环境重塑,避免生物活性组分带来的免疫排斥风险,显著降低治疗成本,适用于临床和战创伤等紧急医疗场景。相关工作以“Micropore structure engineering of injectable granular hydrogels via controlled liquid-liquid phase separation facilitates regenerative wound healing in mice and pigs”为题发表在《Biomaterials》。

图1.微孔结构工程水凝胶的制备及其促进无疤痕伤口愈合的效果示意
研究团队开发了一种独特的W/W/O双乳化方法,采用可控的液-液相分离技术制备初级水乳液(W/W),然后将这种初级乳液加入到油中(W/W/O),形成具有相分离结构的微滴,然后使用紫外光照射交联形成水凝胶微球。根据Stokes定律(V∝1/η)的预测,增加外部GelMA相的粘度会降低PEO相的迁移率和聚结率,并稳定其形貌。在中等PEO体积比(1/3)和高HA浓度(0.5%,w/v)下,可获得期望的连续微孔结构(图2C,2D)。微球内孔隙大小为5~40μm(图2E,2F),适宜细胞浸润。Comsol软件仿真的结果进一步证明了外部水相粘度对内水相融合的重要影响(图2G,2H)。
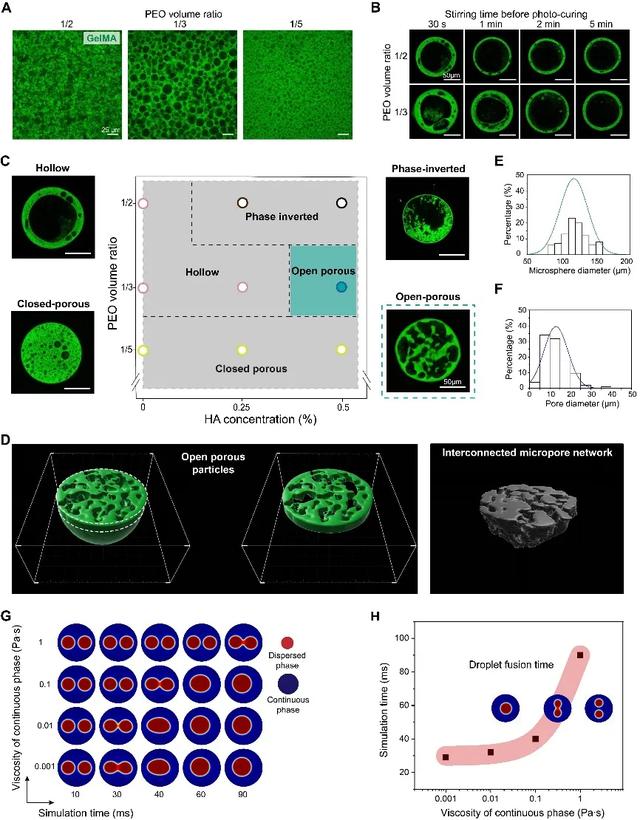
图2.通过控制相分离实现微孔结构精准调控
为了制造基于颗粒的水凝胶支架,研究团队首先将叠氮基团化学偶联到微凝胶表面,然后与多臂聚乙二醇(PEG-DBCO)通过点击化学反应,在5分钟内可以注射并成形(图3A)。共聚焦显微镜显示了PPG支架的内部结构,显示了相互连通的颗粒内和颗粒间的孔隙,而NPG凝胶仅具有颗粒间孔隙(图3B);扫描电镜进一步证实了这一点(图3C)。3D共聚焦图像分析表明,与NPG凝胶(25.5%)相比,PPG凝胶的孔隙度(50.6%)增加了近两倍(图3D)。支架交联前的流变学测试表明,开孔和无孔微凝胶的剪切稀化行为相似(图3E);凝胶化后,PPG凝胶表现出弹性固体行为,储存模量为~170 Pa,略低于化学成分相同的NPG凝胶(图3F)。

图3. PPG水凝胶支架的制备与表征
研究团队采用夹板固定C57/BL6小鼠创面模型(图4A),通过残余创面面积动态监测评估愈合进程(图4B)。实验数据显示,PPG凝胶组在术后第5天和第10天创面闭合率显著优于无孔凝胶组(p<0.05)(图4C)。角蛋白14免疫荧光染色揭示,PPG组第10天已形成完整表皮结构,基底层细胞排列紧密有序(图4D,4E),而对照组仅见不连续薄层表皮。关键组织再生指标显示,PPG支架在D5时间点的细胞密度较NPG及无孔凝胶分别提高2.1倍和3.1倍(p<0.001)(图4F-H)。共聚焦三维重构证实,PPG组细胞可穿透单个微球形成深度浸润网络,而NPG组细胞仅分布于颗粒间隙(图4G插图)。值得注意的是,PPG组第10天支架体积显著减小(图4H),其加速降解特性为新生组织腾出重构空间。CD31/α-SMA双标染色显示(图4I-K),PPG组功能性血管密度达NPG组的4倍(p<0.01),且血管网络均匀分布于整个支架区域。相反,NPG组血管密度从边缘到中心显著下降,中心区域几乎没有新生血管。这种差异印证了多级孔隙结构通过以下机制促进血管化:互连孔道引导内皮细胞定向迁移,加速降解提供空间允许平滑肌细胞包裹塑形,形成成熟血管。

图4.PPG水凝胶在小鼠模型中促进伤口愈合和快速血管化
生物材料支架引发的免疫应答是决定组织再生效果的关键因素。实验数据显示,术后第10天PPG凝胶治疗组的促炎性M1型巨噬细胞(CD68+CCR7+)密度仅为NPG对照组的1/10(图5A-B)。与之形成鲜明对比的是,PPG组中抗炎型M2巨噬细胞(CD68+Arg-1+)与M1亚群的比例显著提升(P<0.01)。更值得注意的是,PPG组创面微环境内调节性T细胞(Treg,CD4+Foxp3+)的浸润浓度达到对照组的4.8倍(图5C-D)。组织学分析显示,Treg细胞在伤口边缘成熟愈合区的密度显著高于核心新生组织区域,印证了其在促进组织稳态重建中的空间特异性调控作用。这些证据链提示,PPG凝胶的三维多孔结构可能通过调控巨噬细胞表型极化,协同增强Treg细胞的募集,从而构建出利于组织功能性再生的免疫微环境。

图5.PPG水凝胶在小鼠模型中调节免疫反应
为评估PPG凝胶对毛囊再生的调控作用,研究团队对术后第21天的创面组织切片进行系统分析。组织学结果显示:空白对照组仅形成纤维化瘢痕组织,NPG组呈现局限性毛囊发育伴随半纤维化基质沉积,而PPG治疗组则成功再生出与健康皮肤组织相当的毛囊结构(图6A-B)。通过SOX9(毛囊干细胞标记物)与Keratin14(毛囊外根鞘标记物)双重免疫荧光染色,进一步验证新生毛囊的完整形态学特征(图6C)。结合术后第10天转录组测序数据显示,PPG组中炎性反应相关通路被显著抑制(图7),从分子机制层面揭示了材料促进皮肤再生的生物学基础。

图6.PPG水凝胶在小鼠模型中促进毛囊再生

图7.手术后第10天小鼠皮肤伤口RNA测序
为验证PPG凝胶的临床转化潜力,研究团队在猪全层皮肤缺损模型中将其与市售人工真皮再生基质(ADRM)进行系统性对比(图8A)。实验数据显示,PPG组与ADRM组在第10天具有相当的创面收缩率(图8B),但组织学分析揭示PPG组呈现显著增强的表皮再上皮化进程(图8C)。值得注意的是,PPG的连通微孔结构结构展现出优异的细胞浸润能力,其组内浸润细胞数量较ADRM组显著提升(P<0.001),且细胞在支架内呈均匀空间分布(图8D)。至术后24天,两组均完成表皮覆盖(图8E),但PPG组实现表皮-真皮连接部结构的生理性重建,其表皮厚度更为均匀(图8F)。同时,PPG组材料完全降解,再生真皮具有类似于健康组织的胶原结构。这些证据表明,PPG凝胶通过精准调控的降解动力学与细胞外基质仿生拓扑结构,建立了利于细胞迁移/分化的动态微环境,从而在保证表皮快速修复的同时促进真皮组织的功能性再生。

图8.PPG在猪模型中促进伤口愈合
本研究创新性地开发了一种基于微孔结构精准调控的水凝胶制备策略,成功实现了皮肤创面的无瘢痕再生修复。实验结果表明,通过拓扑结构优化设计的水凝胶支架具有以下多重生物功能:(1)建立三维仿生微环境,促进宿主细胞的主动迁移与浸润;(2)显著抑制创面过度炎症反应;(3)诱导形成高密度的成熟血管网络。值得关注的是,该技术体系完全摒弃外源性细胞、生长因子或生物活性分子的添加,通过物理-化学协同作用机制实现功能性皮肤组织的原位再生,极大降低了临床转化难度。该突破性技术不仅为皮肤再生医学提供了全新解决方案,其仿生设计理念还可延伸应用于外周神经损伤、肌肉缺损及内脏软组织创面等复杂组织修复领域,具有重要的临床转化价值和广阔的产业化前景。
北京航空航天大学樊瑜波教授和侯森助理教授为该论文的共同通讯作者,博士研究生关淇峰为论文的第一作者。本研究受到国家自然科学基金(32071339,T2288101,12332019,U20A20390)和中央基本科研业务费等项目经费资助。
来源:北京航空航天大学