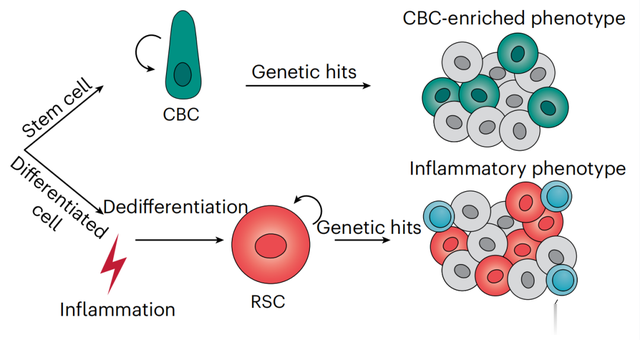
传统主流观念认为,大部分的肿瘤起源于干细胞、具有干细胞特性的细胞或是祖细胞,因为这些细胞能够满足肿瘤细胞所需要的不断增殖、更新和分化的能力【1】。在肠癌发生发展的研究当中,这个概念最早在动物模型中被验证,当在腺窝底部Lgr5+肠道干细胞(intestinal stem cell, ISC)中丧失Apc肿瘤抑制功能后能够成功诱导肠腺瘤的发生,而在定向分化的暂时增殖性细胞(transit amplifying cells)中引入Apc突变时,肿瘤发生则会终止在微腺瘤阶段,这些证据支持了“自下而上(bottom-up)”的肿瘤生成概念【2】。之后,也有另外一种即“自上而下(top-down)”的概念被提出,处于肠隐窝-绒毛轴上部的定向分化肠上皮细胞也可以引起肿瘤的发生,这种概念认为主要发生在组织损伤或炎症情况下【3,4】。炎症可以抑制肠道内干细胞特性,但却是肠癌发生的高风险因素,在这个癌变过程中,细胞如何启动癌变的具体机制还不是特别清楚。
近日,来自荷兰Erasmus Unibersity Medical Center的Riccardo Fodde团队在Nature Genetics上发表了文章Non-stem cell lineages as an alternative origin of intestinal tumorigenesis in the context of inflammation,通过使用动物模型,研究了分化细胞是如何参与炎症环境下细胞癌变过程的机制。研究通过在分化细胞潘氏细胞(Paneth cell, PC, 一种专职为干细胞提供营养并分泌抗菌肽参与肠道免疫屏障建立的分泌细胞)内引入Apc突变发现,这些突变细胞能够引起炎症相关肿瘤的发生。

炎症环境下PC能够诱导肿瘤发生
研究使用Cre-lox系统,根据腺瘤-癌形成理论(adeno-carcinoma sequence),在动物模型中Lgr5+干细胞内和Lyz1+PC细胞内分别突变肠癌相关肿瘤基因(Apc,Kras, Trp53)诱导肠癌的发生,DSS处理诱导肠道炎症发生。研究发现,ISC起源的肿瘤发生,只需要在Lgr5+干细胞引入Apc突变即可,而在PC内,单独引入Apc突变并不能引起癌变发生,但如果加入DSS处理,则大大提高肿瘤发生率,此外,如果在PC谱系中同时引入Apc和Kras突变,或者Apc、Kras和Trp53三个突变,不管有没有DSS处理,肿瘤发生率也都大大提高。这些结果说明Apc突变只有在炎症情况下才能够引起PC起源的肿瘤发生,而当Kras和Trp53突变同时存在时,炎症则不成为癌变的决定性因素, 这和ISC起源的肿瘤是不同的。
PC和ICS起源肿瘤内微环境不尽相同
研究人员对两种肿瘤的发生和微环境进行比对。通过对特定谱系(PC细胞标志物LYZ1和Tuft细胞、肿瘤干细胞标志物DCLK1)进行IHC染色发现,LYZ1+细胞在ISC起源肿瘤和PC起源肿瘤内数量为30% vs 0.48%,在PC起源肿瘤内几乎检测不到PC细胞,而DCLK1+细胞数量约为15.6% vs 54.1%,而DCLK1在以往研究中被认为和升高的免疫浸润相关。Bulk RNAseq比对发现,ISC起源肿瘤内MYC和WEN信号通路被高度激活,而PC起源肿瘤内则表现为炎症信号通路激活,有大量免疫细胞浸润。进一步单细胞测序后发现,PC起源的肿瘤细胞内高表达Cd81, Prom1等复活干细胞(revival stem cell, RSC)相关标志物。这些结果说明,在PC肿瘤发生过程中,PC细胞会去分化为RSC,终止分泌细胞的分化,并引起大量免疫细胞浸润,进入一种特定的肿瘤组织结构。
研究人员进一步对这个研究结果的转化意义进行验证。将本研究内小鼠模型的RNAseq结果和另一项研究结果【5】,通过使用RNAseq对微卫星稳定的后天散发结肠癌组织(sporadic CRC, sCRC)和炎症性肠炎诱导肠癌(Inflammatory bowel disease, IBD-CRC)组织进行对比分析发现,PC起源的肿瘤组织内信号通路和IBD-CRC内信号通路非常相似,证明人炎性结肠癌的发生可能起源于PC细胞。
总的来说,本研究阐述了一种非传统“bottom-up”的肠道成瘤机制,这些肿瘤细胞可以起源于位于腺窝底部的潘氏细胞(或者分泌细胞谱系),在炎症刺激下,分化细胞去分化为复活干细胞,以挽救炎症造成的损伤,提高再生能力,而这种再生能力无疑为肿瘤发生提供更多可能性。这类炎症诱导的肿瘤癌变过程因为具有特定的肿瘤微环境可能会影响药物治疗反应,进而影响预后。
原文链接:
https://www.nature.com/articles/s41588-024-01801-y
制版人:十一
参考文献
[1] Visvader, J. E. Cells of origin in cancer. Nature 469, 314–322 (2011).
[2] Barker, N. et al. Crypt stem cells as the cells-of-origin of intestinal cancer. Nature 457, 608–611 (2009).
[3] Schwitalla, S. et al. Intestinal tumorigenesis initiated by dedifferentiation and acquisition of stem-cell-like properties. Cell 152, 25–38 (2013).
[4] Shih, I. M. et al. Top-down morphogenesis of colorectal tumors. Proc. Natl Acad. Sci.USA 98, 2640–2645 (2001).
[5] Rajamaki, K. et al. Genetic and epigenetic characteristics of inflammatory bowel disease-associated colorectal cancer. Gastroenterology 161, 592–607 (2021).
