碳酸钾:基本属性、主要用途、合成路线、使用注意事项、运输与存储
一、基本属性
碳酸钾(化学式:K₂CO₃)是一种无机化合物,常被称为钾碱、钾碳酸盐,外观为无色或白色结晶粉末,具有潮解性,易溶于水。它是一种重要的碱性盐,具有较强的碱性。其溶液呈碱性,具有与其它钠、钙等碱金属碳酸盐类似的化学性质。
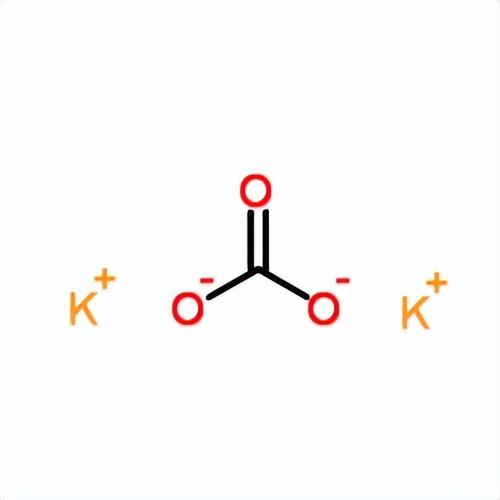
碳酸钾在水中的溶解度较高,在20°C时,其溶解度为 112 g/100 ml。它在溶解时会发生离解,形成钾离子(K⁺)和碳酸根离子(CO₃²⁻)。这种化学性质使得碳酸钾在很多工业和化学反应中都有重要的应用。
碳酸钾名称
中文名: 碳酸钾
英文名: Potassium carbonate
中文别名: 无水碳酸钾 | 桐碱 | 碳酸
CAS号: 584-08-7
碳酸钾物理化学性质
密度: 2.43 g/mL at 25 °C
沸点: 333.6ºC at 760 mmHg
熔点: 891 °C(lit.)
分子式: CK2O3
分子量: 138.21
闪点: 111ºC
精确质量: 137.912155
PSA: 63.19000
外观性状: 白色粉末或颗粒

储存条件
1.贮存于阴凉、干燥、通风良好的库房。
2.包装必须密封完整。防止受潮。应与酸类、潮湿物品等分开存放。
稳定性
1.在空气中极易潮解,可用作干燥剂,并吸收CO2生成碳酸氢钾。易溶于水,其水溶液呈碱性。不溶于乙醇和醚。有很强的吸湿性,易结块,长期与空气接触,易吸收二氧化碳而成碳酸氢钾,其水合物有一水盐、二水盐、三水盐三种。与氯气作用生成氯化钾,与二氧化硫作用而成焦硫酸钾。600℃时与硫酸钡反5 min,有22.5%的硫酸钾形成。如果用硫酸铅代替硫酸钡,有40.9%的硫酸钾形成。工作人员应做好防护,若不慎触及眼睛,应立即用大量流动清水冲洗。工作环境应具有良好的通风条件。易溶于水,在100g水中的溶解度为105.5g(0℃),156g(100℃)。
水溶解性: 1120 g/L (20 ºC)
二、主要用途
1.碳酸钾可用于生产光学玻璃,可提高玻璃透明度、强度和折光系数。
2.也用于生产电焊条,可防止焊接时的断弧现象。
3.用于生产还原染料及其印染及冰染的拔白。
4.用作清除硫化氢及二氧化碳的吸附剂。
5.碳酸钾与纯碱相混合可作干粉灭火剂。
6.也可用作丙酮、酒精生产的辅助原料和橡胶生产中的防老剂。
7.碳酸钾水溶液可用于棉布的煮炼、羊毛的脱脂。
8.还用于油墨、照像药品、聚酯、药、电镀、制革、陶瓷、建材、水晶、钾肥皂及医药的生产。
9.重质碳酸钾主要用作显像管玻壳原料,广泛用于玻璃和特殊玻璃原料,用于大化肥脱碳。
10.可用于食品中作膨松剂。
11.作碱性剂和面团改良剂,且可抑制面条发酸,可用于面制食品,按生产需要适量使用。
12.用于已曝光的感光材料的冲洗加工。
13.用于分析试剂、基准试剂及熔融硅酸盐和不溶性硫酸盐的助熔剂。
三、合成路线
碳酸钾的合成方法主要有以下:
草木灰法是最古老的方法,即从各种植物壳(如棉籽壳、茶子壳、桐子壳、葵花子壳)烧成的草木灰中提取。草木灰中含有碳酸钾、硫酸钾、氯化钾等可溶性盐,用浸取、蒸发、结晶的方法可加以分离。此法由于产品质量低、不经济,且受原料来源限制而很少采用。吕布兰法是将硫酸钾与煤粉、石灰混合,还原焙烧,得黑灰(含碳酸钾、硫化钙等烧成物),经浸取、过滤、蒸发、碳化,得碳酸氢钾,再经过滤、煅烧得产品。此法由于工艺流程长等原因已被其他方法所取代。电解法是将氯化钾电解后得到的氢氧化钾溶液,在碳化塔中以二氧化碳碳化。经多效蒸发器蒸发、过滤得碳酸氢钾,再经煅烧制得产品。此法因原料易得、钾利用率高、无三废产生而得到广泛应用,但耗电较多。离子交换法是用阳离子交换树脂与氯化钾交换。再用碳酸氢铵洗脱成碳酸氢钾稀溶液,经多效蒸发、碳化、结晶、分离、煅烧得产品。此法产品质量好,工艺流程短、适用于小规模生产。
1离子交换法
精制氯化钾溶液(250g/L)经阳离子树脂(732)柱吸附,并用蒸馏水洗涤至无氯离子流出为止。然后用200g/L的碳酸氢铵洗脱至流出液中钾离子低于2g/L为止。加热洗脱液至150℃,再将溶液浓缩至相对密度1.593左右,然后通入CO2气体进行碳化,析出碳酸氢钾结晶,离心分离后用400℃左右热风使碳酸氢钾分解为碳酸钾。KCl+NH4HCO3→KHCO3+NH4Cl2KHCO3→K2CO3+CO2↑+H2O↑
2电解法
氯化钾溶于水(280g/L),然后于精制槽中加入适量的碳酸钾和氢氧化钾,以除去Ca2+、Mg2+,澄清后用盐酸调Ph值至8~10,送隔膜电解槽电解。槽电压2.8~3.5V,槽温60~70℃。电解液中KOH含量10%~15%,蒸发浓缩至50%,冷却至30~50℃析出KCL分离了氯化钾后的溶液,进行预碳化,当KOH浓度低于30g/L时,过滤除去Fe(OH)3沉淀。然后继续浓缩至50%,进行二次碳化,析出碳酸氢钾。分离后于300℃下热风干燥(分解)得碳酸钾。食品级碳酸钾还需将上述工业品溶于水,加入还原剂除去重金属和砷。再经浓缩、结晶、离心、干燥、粉碎,得食品级碳酸钾。2KCl+2H2O→2KOH+Cl2↑+H2↑KOH+CO2→KHCO32KHCO3→K2CO3+CO2↑+H2O↑
3草木灰法
利用各种植物果壳(如棉子壳、茶子壳、葵花子壳等),煅烧制成草木灰,其主要成分有碳酸钾、硫酸钾和氯化钾。先用温水溶解浸提,浸提液中加入少量的石灰乳,经过滤、澄清后蒸发浓缩至相对密度1.318,冷却结晶、过滤以除去硫酸钾。母液浓缩至相对密度1.526,冷却结晶、过滤以除去氯化钾。母液浓缩至刚有晶体析出,冷却结晶、过滤得碳酸钾。也可再将其用水刚好全部溶解,通入CO2气体,使全部碳酸钾转变为碳酸氢钾晶体析出,碳酸氢钾经煅烧得碳酸钾。2KHCO3→K2CO3+CO2↑+H2O↑
四、使用注意事项
1. **腐蚀性和刺激性**
碳酸钾是一种强碱性物质,使用时要注意避免与皮肤、眼睛接触。若不慎接触,应立即用大量水冲洗。对于大面积皮肤接触,应尽早就医。
2. **避免与酸性物质反应**
碳酸钾应避免与强酸性物质接触。在与酸反应时,碳酸钾会中和酸生成二氧化碳气体,可能会产生气体过多而引起压力升高,存在安全隐患。
3. **储存环境要求**
由于碳酸钾具有吸湿性,因此应在干燥的环境中存放,防止潮解。在密闭容器中储存能够有效避免与空气中的水分接触。
4. **化学反应的控制**
在实验中或工业应用时,碳酸钾应根据具体反应的要求使用,避免过量使用或与不相容化学品接触。
五、运输与存储
1. **运输要求**
碳酸钾应遵循一般化学品运输的相关规定。包装应防潮、防潮解,且需确保容器密封良好。在运输过程中应避免与酸性物质及其他化学品发生接触。
2. **储存条件**
碳酸钾应存放在阴凉、干燥、通风良好的地方。储存温度应控制在常温条件下,避免高温和潮湿环境。储存容器应采用防潮的包装材料,避免长时间暴露在湿气中。
3. **应急处理**
在运输或存储过程中,如果发生泄漏,应立即采取措施。泄漏的碳酸钾应使用干燥的吸收剂(如沙土、石灰等)清理,避免与水发生反应,产生氢氧化钾溶液。

结论
碳酸钾是一种重要的无机化学原料,广泛应用于肥料、玻璃制造、清洁剂、水处理、食品工业等多个领域。其优良的碱性特性和化学稳定性使得它在现代化学和工业中占据着重要地位。在使用、储存和运输过程中,需要严格遵守安全操作规程,避免与强酸性物质接触,防止潮湿环境对其影响。通过合理利用碳酸钾的各项特性,可以大大提升生产效率和产品质量,在许多领域取得良好的经济效益。
