仅供医学专业人士阅读参考
点击右上方“关注”,准时接收每日精彩内容推送。
肠道屏障功能障碍与炎症性肠病(IBD)和严重急性胰腺炎(SAP)等疾病相关。虽然,丁酸盐及其衍生物(如丁酸钠,SB)可以缓解肠道的炎症反应,但是,由于生物利用度低,这些物质通常无法充分发挥保护作用。
来自上海理工大学的王世革等团队旨在提供一种用于治疗肠道屏障损伤的微球。首先制备海藻酸钠溶液溶解SB,然后将其与壳聚糖(CS)-原儿茶醛(PA)/氯化钙溶液混合。通过这种方式形成所需的CS-PA/氯化钙藻酸盐/SB(CPC/SB)微球。接下来,通过体内葡聚糖硫酸钠盐(DSS)诱导的IBD模型和牛磺胆酸钠(STC)诱导的SAP模型,探索CPC/SB微球对肠道屏障损伤的治疗作用。结果表明:CPC/SB微球表现出优异的抗氧化性能。体内生物发光成像实验证实,微球在IBD中有效靶向炎症肠道。进一步的体内实验结果表明,微球显著修复了肠道屏障损伤,在IBD和SAP中发挥了保护作用。此外,16S rDNA测序解释了微球能够调节有害菌和有益菌之间的平衡(如Alistipes、Odoribacter和Rikenellaceae RC9)。本研究提供了一种可能的合成策略,将微球载体作为潜在的治疗工具,用于肠道屏障损伤。相关工作以题为“Sodium Butyrate-Loaded Microspheres With Enhanced Bioavailability for Targeted Treatment of Intestinal Barrier Injury”的文章发表在2024年12月04日的期刊《Advanced Healthcare Materials》。

【CPC/SB微球的制备与表征】
首先,基于CS的氨基与PA的醛基之间的快速席夫碱反应制备了CS-PA。通过微乳液法将SB彻底溶解在海藻酸钠中进行负载。然后,加入钙离子(Ca2+)形成海藻酸钙微球。在电荷作用下,带正电的CS-PA可以修饰在带负电的海藻酸钙微球表面,从而形成所需的CPC/SB微球(图1A)。CPC/SB微球表现出净负电荷(图1C),这使得其能够靶向带正电的炎症区域。微球的粒径约为185.5 ± 45.0 nm,有利于微球停留在肠绒毛中。此外,微球表面的儿茶酚基团可以与肠粘膜表面的氨基和羟基形成氢键,有助于微球在肠道中的粘附和长期保留。CS-PA的成功合成通过傅里叶变换红外光谱(FTIR)得到了证实(图1D)。3444 cm−1处的宽吸收峰和2865 cm−1处的弱吸收峰分别归属于CS和CS-PA中-OH和C-H的拉伸振动。CS在1647、1594和1422 cm−1处的峰主要由NH3+的对称和非对称弯曲振动产生。CS-PA中的NH3+峰显著减弱,而在1550 cm−1处出现了一个新的吸收峰,这是由C = N的吸收引起的,表明CS和PA之间发生了席夫碱反应。此外,在CS-PA/海藻酸钠中观察到海藻酸钠中羧基在1030 cm−1处的吸收,证实了CS-PA/海藻酸钠微球的成功制备。此外,1H-NMR光谱也证明了CS-PA的成功合成(图1E)。与CS相比,CS-PA在0.73 ppm处的氨基吸收峰显著减弱,而C = N的吸收出现在8.11 ppm处,这表明席夫碱键的形成。CS-PA在5.93、5.87和5.34 ppm处的吸收是由于PA上的苯环引起的,这验证了CS-PA合成的成功。此外,13C-NMR的结果结合分子结构式也证实了CS-PA的成功合成。

图1 CPC/SB微球的示意图和表征
【CPC/SB微球中SB的载药量和释药量的测定】
本文基于SB磷酸盐溶液在206 nm处的吸光度绘制了SB的标准曲线(图2A)。为了研究微球释放SB的能力,在不同的模拟胃肠液中进行了实验(模拟胃液(SGF)处理2小时,模拟肠液(SIF)处理4小时,以及模拟结肠液(SCF)处理18小时),以模拟微球的自然消化环境。这些不同模拟液体和磷酸盐缓冲液(PBS)中的微球外观被记录下来(图2B)。在放入PBS和SGF后,微球的分散仍然均匀。相比之下,这些微球在SIF中显示出明显的沉淀。随后观察了微球的显微形态(图2C)。在PBS和SGF中孵育后,微球仍呈现球形。然而,在SCF中孵育后,其形态发生了显著变化。这是由于海藻酸钙的耐酸性特点,使得微球在胃中不溶而在肠道中可溶。这一特性有利于通过减少SB不必要的早期释放来实现对肠道的靶向药物输送。如图2D所示,SB主要在肠环境中释放,而在SGF中的释放可以忽略不计。计算得出SB的包封效率为37.8%,载药量为29.04%。由于多孔结构,微球在药物输送方面表现出优异的特性。
【CPC/SB微球的抗氧化能力】
据报道,反应性氧物质(ROS)的过量产生在肠道炎症的发展中起着至关重要的作用,而在炎症部位消除如羟基自由基(·OH)等ROS可能有效缓解IBD。因此,CPC/SB微球的抗氧化能力对于治疗IBD具有重要意义。在本研究中,应用了2,2-二苯基-1-苦基肼基(DPPH)、2,2′-偶氮双(3-乙基苯并噻唑啉-6-磺酸盐)(ABTS)和水杨酸方法来评估制备的CPC/SB微球对DPPH·、ABTS·和·OH的清除活性。如图2E,F所示,DPPH·或ABTS·溶液最初呈现紫色或蓝绿色。然而,加入微球后,其颜色逐渐变浅并最终褪色。这是因为微球能显著清除自由基并降低吸光度,这表明CPC/SB微球具有优异的抗氧化性能。此外,如图2G–I所示,随着孵育时间的延长,微球对ABTS·、DPPH·和·OH的清除效率均持续增加并保持高水平。作为众所周知的抗氧化剂,维生素C(L-抗坏血酸)参与各种过程,如促进铁吸收和支持上皮屏障功能。在这一部分,本文进一步将CPC/SB微球的抗氧化能力与作为阳性对照的维生素C进行了比较。相关数据显示,CPC/SB微球对DPPH·的消除率接近80%,而其对ABTS·和·OH的消除率达到90%以上,明显高于维生素C,表明微球具有出色的总抗氧化能力和自由基清除活性。
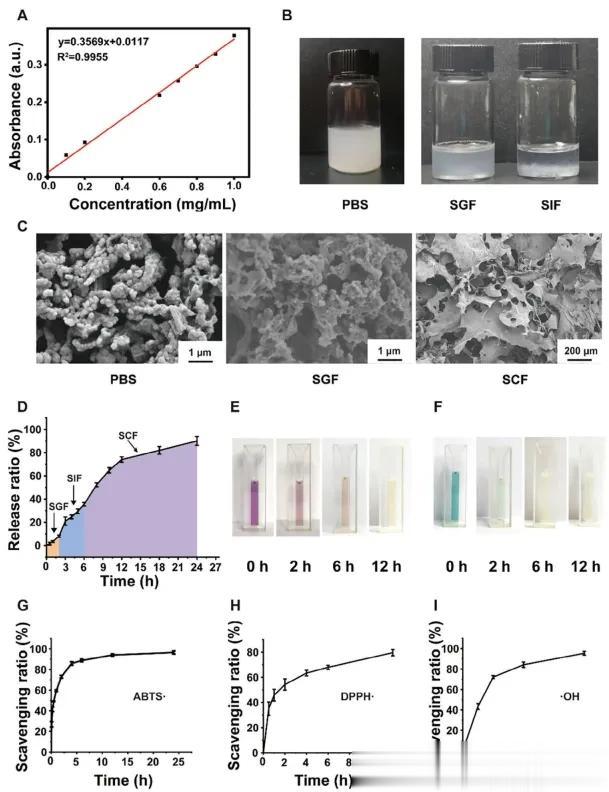
图2 CPC/SB微球在不同模拟液体中的SB负载和释放以及CPC/SB微球的抗氧化能力
【CPC/SB微球对IBD的体内治疗效果】
为了评估CPC/SB微球对肠道屏障损伤的保护效果,本文在DSS诱导的IBD小鼠模型中研究了这些微球的效果。IBD + SB、IBD + CPC和IBD + CPC/SB组的小鼠在7天内饮用含2%(w/v)DSS的水,并在整个建模期间每天灌胃10毫克的SB、CPC和CPC/SB微球;饮用正常水或含2%(w/v)DSS的水但未进行微球处理的小鼠作为对照(对照组和IBD组)。如图3A所示,与对照组小鼠相比,IBD组小鼠的体重显著下降,这与IBD相关的临床症状——体重减轻一致。幸运的是,应用CPC/SB微球缓解了体重减轻。此外,测量了结肠的长度(图3B,C)。在IBD过程中,由于炎症反应,结肠长度显著缩短(p < 0.01)。尽管灌胃SB、CPC和CPC/SB微球都能显著防止IBD引起的结肠缩短,但CPC/SB微球显示出最有力的保护效果(p < 0.01)。因此,本文后续的研究主要集中在CPC/SB微球上。

图3 CPC/SB微球在DSS诱导的IBD模型中表现出显著的缓解效果
【在类器官水平上CPC/SB微球的安全性和治疗效果】
本文通过免疫荧光染色增殖标记Ki67、凋亡标记TUNEL以及重要紧密连接蛋白(包括ZO-1、Claudin-1和Occludin)来评估CPC/SB微球在结肠类器官中的安全性及其对IBD类器官的影响。免疫荧光染色结果表明,经微球处理的类器官中Ki67和TUNEL的表达水平与对照组类器官一致(图4A,B),表明CPC/SB微球对结肠类器官的增殖和凋亡没有显著影响。此外,通过关键紧密连接蛋白的表达证明了CPC/SB微球的有效性。如图4C–E所示,IBD组中ZO-1、Claudin-1和Occludin(绿色)的表达显著低于对照组,暗示IBD过程中紧密连接受到影响。此外,CPC/SB微球的处理能显著上调IBD类器官中这些重要紧密连接蛋白的表达水平。这些观察结果表明,CPC/SB微球是安全的,并在IBD类器官模型上显示出明显的治疗效果。

图4 CPC/SB微球在类器官水平上对IBD的安全性和治疗效果
【CPC/SB微球在体内的结肠积累和炎症靶向性】
为了研究CPC/SB微球在体内的炎症靶向性,本文在建模过程的第7天给对照组和IBD组的小鼠灌胃Cy7标记的CPC/SB微球,并通过荧光成像系统(Tanon ABL X6 PRO)检测不同时间点后微球在结肠中的分布。如图5A所示,9小时和12小时后,IBD组的平均荧光强度显著高于对照组,这表明CPC/SB微球更倾向于靶向炎症部位。22小时后,两组均未观察到显著的荧光表达。在灌胃后22小时,收集了小鼠的脾脏和结肠组织(图5B)。显然,CPC/SB微球在两组中的胃和结肠中聚集。然而,IBD组中微球的积累水平更高,这也证明了微球的炎症靶向特性。

图5 CPC/SB微球在IBD模型中的靶向递送和微球在SAP模型中的治疗效果
【CPC/SB微球对体内SAP的影响】
通过将免疫学方法与荧光标记技术相结合,免疫荧光通常用于研究细胞内特定蛋白抗原的分布。MPO是一种主要由中性粒细胞表达的ROS产生酶,而F4/80是巨噬细胞的特征标志物。如图5E所示,与对照组相比,SAP组中F4/80(绿色)和MPO(黄色)的荧光表达较高,证实了在SAP过程中结肠中的巨噬细胞和中性粒细胞浸润。然而,SAP + CPC/SB组中这两种标志物的荧光表达明显低于SAP组,这表明微球可以有效减少炎症细胞(即本研究中的巨噬细胞和中性粒细胞)的表达并缓解炎症反应。在本研究中,结肠组织切片的免疫荧光显示,SAP组中ZO-1(红色)、Occludin(黄色)和Claudin-1(绿色)的荧光表达显著低于对照组,表明肠道黏膜紧密连接相关蛋白的表达减少,这与肠道黏膜屏障功能受损有关。相比之下,SAP + CPC/SB组中ZO-1、Occludin和Claudin-1的荧光表达明显高于SAP组,表明微球对SAP期间肠道黏膜屏障损伤具有保护作用(图5E和图6A)。
靶向代谢组学的结果显示,粪便中丁酸的浓度在早期(9,12小时)增加。然而,SAP + CPC/SB组中的丁酸水平高于Control + CPC/SB组,进一步支持了CPC/SB微球在SAP小鼠中更快释放丁酸(图6B)。24小时后粪便中丁酸的浓度降低,证实CPC/SB微球可以从体内安全排出。为了研究CPC/SB微球对肠道屏障损伤的影响,本文测量了不同组SAP小鼠血清中的LPS和FITC-dextran水平(图6C,D)。SAP组中的LPS水平显著增加,表明SAP建模导致屏障完整性受损。相反,灌胃CPC/SB微球后,血清LPS水平显示出明显的下降趋势(图6C),表明微球能够修复屏障损伤。此外,血清FITC-dextran浓度表明,SAP组中的肠道屏障通透性显著高于对照组,表明SAP建模损害了肠道屏障完整性(图6D)。灌胃CPC/SB微球有效地逆转了这一变化,进一步支持了微球修复肠道屏障损伤的能力。

图6 SAP模型中的肠道屏障损伤及CPC/SB微球对SAP的治疗作用
【16S rDNA测序分析】
最后,为研究CPC/SB微球对肠道菌群的多样性和组成的影响,本文收集了不同组小鼠的粪便,并进行了16S rDNA测序分析。从Chao1、观察到的物种数和Shannon指数的稀释曲线可以看出,与对照组相比,IBD组样本的丰富度和多样性显著降低,这证实了IBD模型的建立对肠道菌群造成了损害(图7A)。单独使用SB(IBD + SB组)可以在一定程度上改善微生物多样性的减少。然而,灌喂CPC/SB微球(IBD + CPC/SB组)可以显著增加样本的丰富度和多样性,这表明微球可能与SB协同作用以平衡肠道菌群。
本文使用了主坐标分析(PCoA)和非参数多变量方差分析(Adonis)来分析粪便样本中微生物组成的差异。基于Jaccard距离矩阵进行的PCoA分析结果如图7B所示。观察到每组内粪便样本之间的距离相对较近,表明同一组内的微生物组成和结构相似。Control组和IBD组样本之间的距离有显著差异,表明IBD模型成功建立。肠道炎症会导致肠道菌群失衡,微生物组成和结构发生显著变化。

图7 不同治疗组小鼠粪便样本的α多样性、β多样性和物种丰度分析
【总结与展望】
在本研究中,通过微乳液法结合壳聚糖(CS)、原儿茶醛(PA)、海藻酸钠(SA)和丁酸钠(SB),合成了CPC/SB微球,以保护肠道屏障免受IBD和SAP引起的损伤。合成的微球表现出高的组织相容性和显著的抗氧化能力,且在体外对细胞活力和细胞迁移没有显著影响。由于氯化钙藻酸盐的耐酸性特性,这些微球在胃中不溶解而在肠道中溶解,这通过在模拟生理环境(如胃液和结肠液)中的微球形态显著不同得到证实。具体来说,微球在SGF中保持相对完整的球形,而在SCF中发生分解。此外,CPC/SB微球的特性如负电荷使其更容易通过电荷相互作用靶向IBD小鼠结肠中带正电荷的炎症区域,然后CPC/SB微球分解并高效释放丁酸,发挥其抗炎和保护肠道屏障损伤的作用,显著改善紧密连接蛋白ZO-1和炎症指标(如MPO、CD86和F4/80)。潜在的治疗机制可能如下:i) 作为结肠上皮细胞的主要能量来源,丁酸本身对细胞能量代谢和肠道稳态具有有益效果;ii) 丁酸通过组蛋白去乙酰化酶-3抑制来保护抗炎反应和紧密连接的破坏,这一点通过证明丁酸包封的微球可以显著增加肠上皮细胞中紧密连接蛋白ZO-1的表达而得到验证;iii) CPC/SB微球对肠道微生物群的多样性和组成有显著影响,如本研究中粪便物种丰度分析和16S rDNA测序结果所示;iv) CPC/SB微球允许包封的SB不在消化道前端释放,而是在受损的肠道屏障处准确释放以发挥其治疗效果。本研究提供了一个实际的方法,提高了SB针对肠道屏障损伤的靶向和治疗效率,这也有助于基于CS的纳米载体的临床转化应用。
了解更多
关注“EngineeringForLife”,了解更多前沿科研资讯
