
MRD,即分子残留病灶(亦称微小残留病灶或可测量残留病灶),其概念源于血液肿瘤,是指经过治疗后,影像学或传统实验室方法不能发现,但通过液体活检发现的肿瘤来源分子异常(外周血可稳定检出丰度≥0.02%的ctDNA,包括驱动基因或其他的I/II类基因变异),代表着肿瘤的持续存在和临床进展可能[1]。广义上说,MRD的检测内容可包含体液(常见为血液)中来源于肿瘤细胞的特异性标志物,包括但不限于ctDNA、ctRNA、CTC、外泌体及其他物质,检测范围包括了基因组学和蛋白组学[2][3]。基于NGS的ctDNA突变检测是目前实体瘤MRD检测最常用的方法。在结直肠癌、非小细胞肺癌和乳腺癌中,有充分证据表明MRD具有预后分层作用,临床价值较明确;在胰腺癌、肝癌、食管癌、胃癌等其它实体瘤中,也有一些证据提示MRD具有预后分层作用[4]。
那么,MRD到底什么时候做?怎么做?本文将分两期通过MRD的分析策略、Landmark检测时间点、临床意义、检测难点等方面进行阐述。
MRD的分析策略实体瘤MRD检测根据是否参考肿瘤组织突变信息分为肿瘤组织先验分析(tumor-informed)和肿瘤组织未知分析(tumor-agnostic/naive)两种分析策略。
肿瘤组织先验分析(Tumor-informed assays)需要对肿瘤组织进行WES(或大panel)+个性化panel的检测。肿瘤组织先验(Tumor-informed)策略首先需要对患者的肿瘤组织进行高通量测序(以WES为主),确定每位患者的肿瘤特异突变,并且选择一定数量的高丰度的躯干突变定制个性化panel(通常只包括16~50个肿瘤特异突变),最后在患者血浆ctDNA中检测这些突变,相当于WES(或大panel)+个性化panel的检测。该分析策略因检测突变靶点少,大幅降低了由于技术和生物背景(比如克隆性造血)导致的假阳性风险,也因此可以进行极高深度的测序,提高检测的灵敏度。目前市场上MRD产品多基于此策略。
Tumor-informed还有一种固定panel检测策略:在基线组织检测后,后续监测使用固定Panel。Panel通常基于常见驱动基因和靶向药物作用位点进行设计,这限制了其适用性,市场上较少见到。
肿瘤组织未知分析(tumor-agnostic/naive)不需要获取肿瘤组织,直接进行固定化panel检测。该策略主要是用一个普适性、一般有三四百个基因甚至更多基因的大panel进行检测,相当于固定化panel的检测。采用固定的突变panel,无须预先获取患者肿瘤组织进行测序,可以大幅简化流程、降低成本及缩短患者MRD状态评估周期。在制定患者辅助治疗的决策过程中,辅助治疗的延迟可能会降低治疗疗效,因此快速评估患者MRD状态,从而尽早进行临床决策也十分重要[5]。
这两种策略孰优孰劣呢?
三种策略对比[6][7]
MEDAL研究是全球首个早期肺癌头对头对比三种MRD检测策略的前瞻性临床研究,该研究中,所有选择的变异中有98.2%是非标准的,其中99.9%是唯一存在于一个患者中的。如果只监测标准的突变,近一半landmark(治疗后的单个时间点)的MRD阳性样本将无法识别。
同时发现PROPHET(Tumor-informed定制化Panel)在基线时对DFS和OS的预测能力高于Tumor-agnostic和Tumor-informed固定化Panel检测。在实体瘤分子残留病灶(MRD)检测共识中也明确提到基于肿瘤组织突变的tumor-informed分析相对于tumor-agnostic/naive分析具有更好的敏感性和特异性,优先考虑采用tumor-informed分析策略。
Landmark检测时间点01.新辅助治疗
CTONG1804是一项前瞻性多中心II期研究基于PD-L1表达评估了新辅助nivolumab单药(N)和nivolumab-化疗(N/C)组合的临床疗效。
对38名患者在治疗前收集的血浆样本进行分析,在89.5%(34/38)的治疗前样品中检测到ctDNA,包括21.1%(8/38)的II期疾病和68.4%(26/38)的III期疾病。ctDNA检出率在新辅助治疗期间下降,从治疗前(T0)的89.5%下降到新辅助治疗后(T2)的34.2%,然后在手术后(T3)继续下降到27.6%。具体来说,新辅助免疫单药N和N/C分别使ctDNA阳性率降低42.9%(T3)和18.2%(T3)。
在所有局部和远处复发的患者中,至少在一个点上观察到可检测的ctDNA。ctDNA/MRD–(T2和T3)患者与ctDNA/MRD+(T2或T3)患者的18个月EFS率分别为93.8%和47.3%。结果提示:新辅助治疗和手术后两个时间点的ctDNA阴性,可预测pCR和生存益处,需在前瞻性临床试验进一步证实。
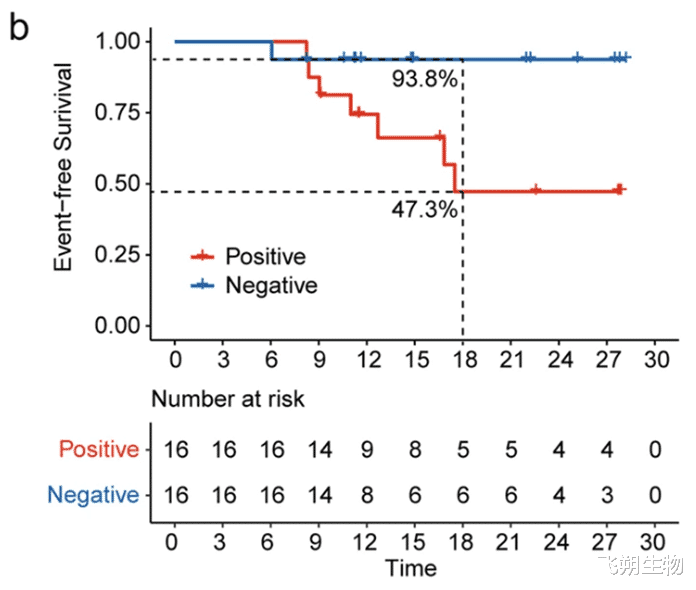
ctDNA/MRD –(T2和T3)患者与ctDNA/MRD+(T2或T3)患者的EFS[8]
MRD对新辅助治疗疗效的评估价值在膀胱癌[9]、结直肠癌[10]、乳腺癌[11]等也均已有文献报道,现有证据提示新辅助治疗后ctDNA清除对于预测远处复发是潜在的有效标志物:若患者接受新辅助治疗后ctDNA阳性,则可能预后较差,不适合进行器官功能保留,需考虑及时调整治疗方案。基于ctDNA的MRD状态评估可潜在辅助临床筛选适合采用非手术治疗方案的优势人群,为进展期患者的精细化全程管理提供新思路。胃癌患者若接受辅助治疗则建议在治疗前接受MRD检测,有助于判断预后和制订进一步的治疗随访策略;接受新辅助治疗的局部进展期胃癌患者在治疗过程中可考虑行MRD动态监测[12]。
然而,术前ctDNA-MRD结果并不总是与其在术后的结果保持相关性,有研究发现,在47位复发非小细胞肺癌患者中,14例患者在术前MRD检测结果为阴性,但在术后监测中却为MRD阳性[13]。这表明术前ctDNA-MRD结果并不影响其在术后监测中的结论,且更加明确了术后MRD监测的重要性。
研究发现,患者术前ctDNA-MRD状态与多个因素存在关联,包括肿瘤大小、肿瘤分期、病理类型、基因型等。具体来说,肿瘤体积越大、分期越晚,其术前ctDNA-MRD阳性率越高[14][15]。关于术前ctDNA-MRD检测的结果在预后方面的作用尚未达成一致的结论。术前ctDNA-MRD在不同癌种或不同病理类型中存在异质性,还需要更多研究明确其在不同癌种中的预后预测价值。
02.根治性治疗之后,辅助治疗之前
目前,MRD大多数首次检测都在此时。
NCT02965391研究在手术前即刻(时间A)和肿瘤切除后多个预先指定的时间点[时间B(5分钟)、时间C(30分钟)和时间D(2小时)]和手术后[时间P1(1天)、时间P2(3天)和时间P3(1个月)]获得10毫升血浆样品。肿瘤根治术后ctDNA迅速衰减。在术后1天时MRD阳性和阴性患者的平均RFS和平均OS都无显著差异;而在术后3天和术后1个月时MRD阳性和阴性患者的RFS和OS存在显著差异。提示术后3天和术后1个月的MRD检测结果与患者的肿瘤复发和生存更为相关。

术后1天时MRD阳性和阴性患者的平均RFS和平均OS[16]
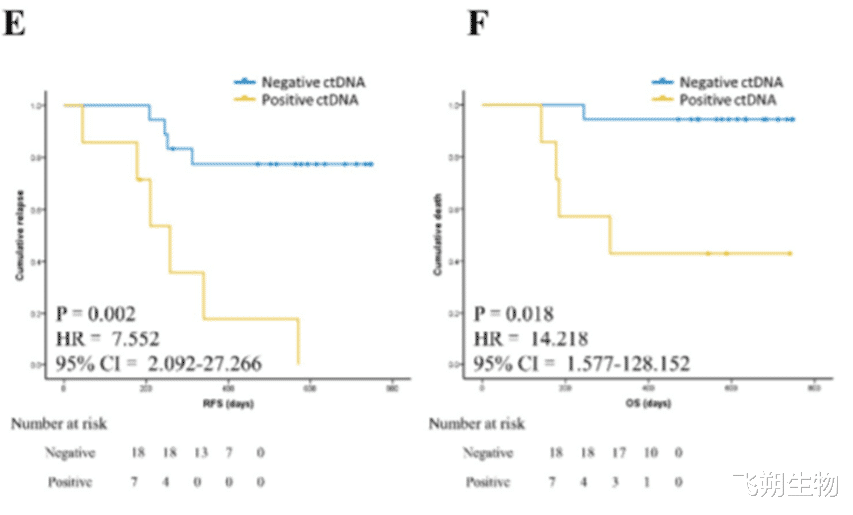
术后3天时MRD阳性和阴性患者的平均RFS和平均OS[16]
目前对于MRD基线分析采样时机、检测时机均未有统一标准,非小细胞肺癌分子残留病灶专家共识推荐MRD首次检测的时间窗在NSCLC根治性治疗后1周到1个月之内。胃癌分子残留病灶检测与临床应用中国专家共识(2023版)推荐进展期胃癌在根治性手术后或术后首次随访时,可考虑行MRD检测。美国专家建议手术后两周采集初始血液样本进行基于ctDNA的MRD检测,当为阴性结果后,可以缩短监测时间(如1个月后)进行阴性结果的再确认,但应在辅助治疗开始前完成[17]。
综上并结合共识,笔者推荐实体瘤患者MRD首次检测点应在根治性手术之后1周至一个月内,辅助治疗开始之前;根治性放化疗之后,巩固治疗之前或放疗进度一半时[18];系统治疗后完全缓解的晚期患者为宜。术前检测可评估新辅助治疗效果,对预后的评估重点要看术后MRD状态。
03.Longitudinal检测延续时间
Longitudinal指在根治性治疗后的一系列时间点上进行连续性监测,如术后3个月、6个月等,以全面评估患者的疾病进展可能和MRD状态的动态变化。在此期间患者的MRD结果均为阴性者,则定义为Longitudinal阴性;如果在任意监测时间点上,患者的MRD检测结果为阳性,则定义为Longitudinal阳性。多个研究的汇总分析表明,术后Landmark单点MRD阳性始终与患者的不良预后密切相关,特异性大于90%,但是敏感性相对较低,中位敏感性为56%。说明Longitudinal的结果对患者分层具有更好的敏感性和特异性,文献报道其敏感性达到了100%,中位敏感性为89%[19]。上述结论表明:长期动态监控对于复发风险的评估更准确。
在CIRCULATE-Japan研究中,研究者根据结直肠癌患者术后4周和12周的MRD检测结果,将患者分为持续阳性、阳性转阴性、阴性转阳性、持续阴性性四组,结果表明“阳性转阴性”组的DFS较“阳性转阳性”组有显著提升(81.4%vs33.8%)。再次强调了长期监控的重要性。

四组的DFS比较[20]
那么,Longitudinal要持续多长时间?吴一龙教授团队在晚期肺癌患者适应性降阶治疗研究中,患者的中位随访19.2个月,整体人群的中位无进展生存期(PFS)为18.4个月[21]。非小细胞肺癌的相关研究表明,术后12至18个月是MRD高峰检测时间范围。若患者维持MRD阴性超过18个月,复发的风险就会逐步降低。
综上,笔者建议患者每3~6个月进行一次MRD检测,持续至少2年。具体检测时间可与患者返院随访时间结合。
亦有观点认为对于1B期及以后的建议每3个月复查一次,到术后三年;对于1B期之前的患者术后建议3-6个月复查一次,同步随访MRD检测。但未见其出处,仅供参考。
飞朔生物检测策略飞朔生物自主研发的实体瘤分子残留病灶(MRD)检测产品采用定制化Panel检测策略,先对原发肿瘤组织进行全面的全外显子测序,确定患者特异的基因突变结果,然后定制个性化Panel对组织中的一定数量的突变位点进行后续的ctDNA检测。对比同类产品优势明显。
自主研发肿瘤版WES(全外显子测序)检测,在WES的基础上增加肿瘤热点突变区域、常见基因融合相关的内含子区域、非编码区ClinVar致病性位点、SNP骨架和MSI区域的探针覆盖;基线样本检测结果覆盖导靶向治疗,免疫治疗和遗传风险评估;
个体化定制panel采用自研的单侧引物扩增结合UMI的测序文库构建技术;
自动化监测位点筛选,通过突变位点的频率,基因的功能,突变类型和突变等级等指标加权评分,从位点的筛选提高监测的灵敏度;
采用超高深度测序(100000X)结合UMI分析可以实现0.05%的突变检测灵敏,满足MRD的检测性能要求;
基线分析+多次动态监测,肿瘤诊疗全周期MRD动态监控;
灵活性全周期管理,多向选择;
适用于多种实体瘤的预后预测、复发风险评估、疗效监测。
参考文献
[1] 非小细胞肺癌分子残留病灶专家共识
[2] 微小残留病灶检测在实体瘤中的应用及进展
[3] 微小残留病灶在非小细胞肺癌中的研究进展与应用
[4] 实体瘤分子残留病灶(MRD)检测共识
[5] MRD检测行业报告(2023)
[6] Cancer Discov 2021 Dec 1;11(12):2968-2986.
[7] Cancer Cell. 2023 Oct 9;41(10):1749-1762.e6.
[8] Signal Transduct Target Ther 2023 Dec 6;8(1):442.
[9] AEur Urol. 2022 Aug;82(2):212-222.
[10] PLoS Med 2021 Aug 31;18(8):e1003741.
[11] Cancer Cell. 2023 Jun 12;41(6):1091-1102.e4.
[12] 胃癌分子残留病灶检测与临床应用中国专家共识(2023版)
[15] Nature. 2023;616(7957):553-562.
[16] Clin Cancer Res. 2019;25(23):7058-7067.
[17] Nature 2023 Jul;619(7969):259-268.
[18] Cancer Cell 2023 Oct 9;41(10):1763-1773.e4.
[20] Nat Med 2023 Jan;29(1):127-134.
[21] JAMA Oncol 2024 Jul 1;10(7):932-940.
声明:本文仅用于分享,如涉及版权等问题,请尽快联系我们,我们第一时间更正,谢谢!
