编者按:急性视网膜坏死(ARN)是一种罕见的感染性全葡萄膜炎,表现为从周边环形向后极发展的坏死性视网膜炎、闭塞性血管炎以及玻璃体炎[1]。ARN的常见病因是水痘-带状疱疹病毒(VZV),其次是单纯疱疹病毒1(HSV1)和单纯疱疹病毒2(HSV2)等疱疹病毒。眼内液聚合酶链反应(PCR)可检测病原体、确诊ARN[1,2];实时定量PCR也有助于监测抗病毒治疗过程中ARN的程度[3,4]。近年来,宏基因组测序被应用于眼内液检测中,其可通过检测特定基因或变异,以预测对抗感染治疗的可能耐药性[5,6,7,8]。然而,ARN中病毒基因组变异的情况、这些变异与临床表现和抗病毒治疗反应的相关性仍有待进一步研究。此外,抗病毒治疗中,早期的病毒载量曲线由平台期和对数衰减期组成[3,4,7],病毒载量的平台期长度被认为与抗病毒治疗的有效性、病毒的耐药性相关。然而,在ARN病例中尚缺乏可有效测量平台期长度的方法;既往研究曾使用病毒载量下降至初始载量一定比例所需时间来估计平台期长度,如较初始载量下降0.5个log(下文简称T-0.5log)、下降10%(下文简称T-10%)、下降一半(下文简称T1/2)所需时间,但其准确性不明。近期,复旦大学附属眼耳鼻喉科医院常青教授与周旻副主任医师报导了VZV引起的ARN中动态病毒载量监测和宏基因组学研究:动态病毒载量监测、计算病毒载量的平台期长度可帮助估计ARN患者抗病毒治疗期间坏死性视网膜炎的病程长度;宏基因组测序有助于检测病原体的感染和基因变异,RNR基因的功能缺失变异(loss-of-function)可能导致VZV病毒毒力降低。目前,该研究结果已在RETINA杂志上正式发表。
研究方法
该研究为回顾性病例系列研究。
01
入排标准
入选标准:①PCR证实病原为VZV的ARN病例;②抗病毒治疗过程中病毒载量检测≥4次。排除标准:①基线时房水量不足,无法进行宏基因组测序;②未能完成抗病毒治疗或在眼部缓解前失访。02
抗病毒治疗方案
确诊ARN后,开始眼部+全身抗病毒治疗。
眼部治疗:更昔洛韦玻璃体内注射(每周2次)→直到活动性视网膜炎缓解or视网膜脱离需要手术。全身治疗:阿昔洛韦静脉用药14天后改为伐昔洛韦口服给药3-6月。03
临床评估
视网膜坏死的范围:(图1)Zone 1:锯齿缘-赤道部(绿色);
Zone 2:赤道部-黄斑外3000μm&视神经外1500μm(红色);
Zone 3:黄斑外3000μm&视乳头外1500μm(黄色)。

图1 视网膜坏死分区
视网膜病程:为视网膜炎的持续时间,即开始抗病毒治疗→坏死性视网膜炎完全缓解之间的时间间隔。治疗过程中观察并记录视网膜脱离的发生情况。04
病原学和病毒载量检测
每次玻璃体内注射前,通过前房穿刺术获取房水。
第1次注射(D1)时,50μL房水用于PCR检测病原体类型(HSV1、HSV2、VZV、EBV、CMV)。如果检测到VZV,则在眼部抗病毒治疗的第1天(D1)、第3天(D3)或第4天(D4)、第1周(W1)、第2周(W2)、第3周(W3)和第4周(W4)对收集的房水进行病毒载量检测;对于每位患者,将不同时间点的房水标本保存在-80°C,最后一起全部检测,以尽量减少系统误差的影响。
05
病毒载量曲线拟合
使用MATLAB的曲线拟合工具分析病毒载量的趋势(图2)。
图A:平滑样条曲线(绿色)用于可视化病毒载量曲线的趋势。
图B-E:按照以下步骤拟合指数曲线(黑色虚线)。为减少平台期的影响,拟合出更接近对数衰减期的指数曲线,从基线开始从前往后逐一排除点(红叉);如进一步排除后R2值没有显著增加,或剩余测量点少于3个,则停止排除;(D)中的曲线被认为是对数衰减期的最佳拟合曲线,因为(E)中进一步排除并没有导致R2值显著增加。
图F:最终预测的病毒载量曲线由平台期曲线(以绿色样条曲线表示)和对数衰减期曲线(以黑色指数曲线表示)组成。以两端曲线交界两点的中点(以蓝色点表示)作为病毒载量由平台期进入对数衰减期的拐点。
由基线至拐点的时间即为预测的平台期长度(简称为拐点时间,Tinflection)。同时,按既往研究方法计算其他的平台期预测值:T-0.5log、T-10%、T1/2。
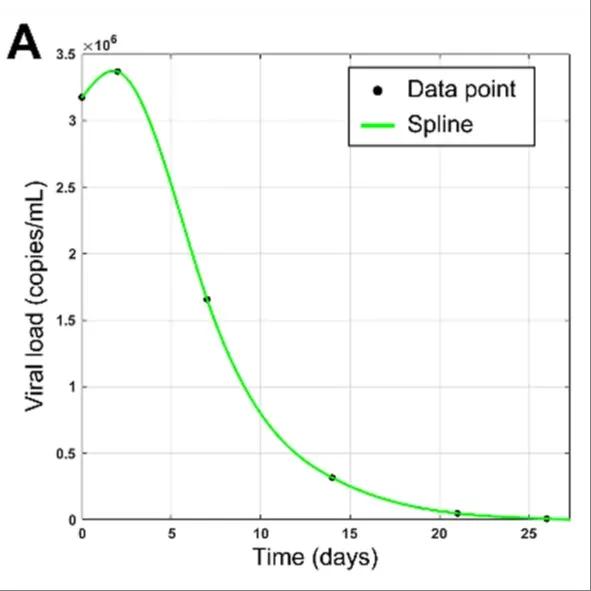
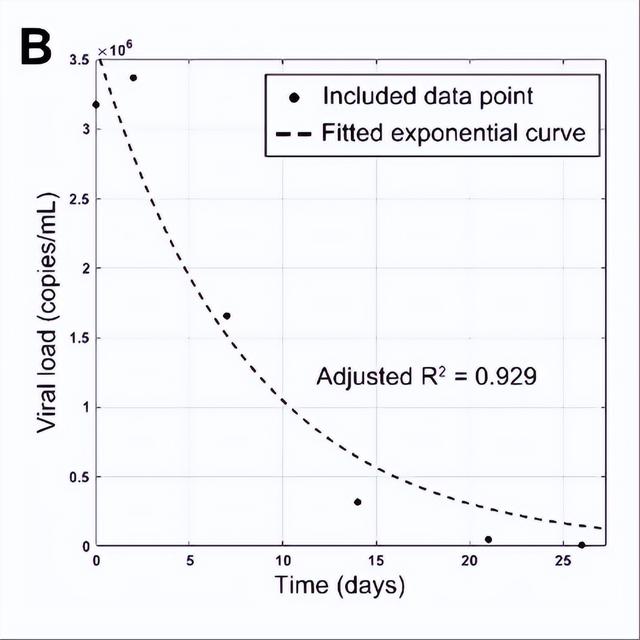




06
宏基因组测序
第1次注射(D1)时,另外50μL房水用于宏基因组测序。
由于病毒胸苷激酶(TK)、DNA聚合酶(DNA pol)和核糖核苷酸还原酶(RNR)基因与抗病毒药物的活性有关[8,9],将VZV基因组中的DNA pol基因、TK基因和RNR基因序列与NCBI VZV基因组参考序列(https://www.ncbi.nlm.nih.gov/nuccore/NC_001348.1)进行比对,以检测这些基因的变异。
研究结果
01
人口学特征
共纳入20人(10男10女)20眼(10右10左),平均年龄52±10岁,平均随访时间13±6月(95% CI:10-16月)。
基线视网膜坏死的范围:4眼仅累及Zone 1;11眼累及Zone 1+2;5眼累及Zone 1+2+3。病程及预后:13眼的坏死性视网膜炎达到缓解,缓解的平均时间为5±3周(95% CI:3-7周);其余7眼在视网膜炎缓解之前发生视网膜脱离。共14眼发生视网膜脱离,发生视网膜脱离的中位时间为6.0周(IQR:3.0-7.0周,range:1.5-24.0周)。02
病毒载量分析
2.1 抗病毒治疗过程中病毒载量测量的趋势(图3)
抗病毒治疗开始后,病毒载量总体呈指数下降趋势。
病毒载量的对数与治疗时间呈负线性相关(P<0.001,R2=0.731)。

图3 抗病毒治疗过程中病毒载量测量的趋势
散点表示不同时间点病毒载量的对数;每个颜色代表一个患者;虚线间的灰色区域为拟合线的95% CI
2.2 病毒载量曲线的时间参数
病毒载量到达拐点的时间(Tinflection):平均4.2±1.6天(95% CI:3.4-4.9天)。病毒载量减半的时间(T1/2):中位数8.3天(IQR:6.0–8.9天,range:1.7–19.6天)。病毒载量下降10%的时间(T-10%):中位数4.2天(IQR:1.0–6.4天,range:0.3–15.9天)。病毒载量下降0.5log的时间(T-0.5log):中位数:9.6天(IQR:8.4–11.5,range:6.1–21.4天)。使用Friedman检验对4个时间参数进行比较,结果表明:Tinflection短于T-0.5log(P<0.001,Bonferroni adjustment)和T1/2(P<0.001,Bonferroni adjustment),与T-10%无统计学差异(P>0.999,Bonferroni adjustment)。进一步分析发现,11眼中T-10%<Tinflection,9眼中T-10%>Tinflection。这些结果表明:
T-0.5log和T1/2位于对数衰减期。T-10%可位于病毒载量曲线拐点之前或之后。2.3 视网膜病程与病毒载量曲线时间参数的相关性
使用Spearman相关分析评估坏死性视网膜炎病程与病毒载量曲线时间参数的相关性,视网膜炎病程与Tinflection相关(P=0.025,Spearman ρ=0.617),但与T-10%、T1/2和T-0.5log无关(P分别=0.942、0.716、0.662)。这些结果表明:
Tinflection可能有助于估计坏死性视网膜炎的病程03
宏基因组测序
3.1 qrtPCR病毒载量与宏基因组测序读数的相关性(图4)
VZV读数与qrtPCR测定的病毒载量正相关(P=0.024,Spearman correlation)。

图4 qrtPCR病毒载量与宏基因组测序读数的相关性
3.2 VZV基因变异情况
DNA pol基因、TK基因、RNR亚基1(RNR1)基因和RNR亚基2(RNR2)基因共检测到31个变异,其中同义变异13个,错义变异15个,插入变异1个,无义变异2个;去除同义变异后,DNA pol基因、TK基因和RNR1基因的非同义变异分别为10个、2个和6个(表1)。各基因、变异之间无显著的相关性。
表1 宏基因组测序检测VZV基因变异情况

3.3 VZV基因变异与病毒载量、时间参数、临床表现的相关性
VZV RNR1基因c.2144C.A (p.S715*) 无义变异的ARN患者的初始病毒载量低于无该变异的ARN患者(中位数:1.3×107copies/mL vs 1.1×108copies/mL;P=0.005,FDR-adjusted P=0.030)。
各变异均不影响视网膜病程、T1/2、T-10%、T-0.5log、Tinflection。
基线视网膜坏死分区、视网膜脱离发生率、BCVA与基因变异间无显著相关性。
研究结论
动态病毒载量监测可预测病程长度,治疗初期不符合指数下降趋势的载量数据可用于预测平台期的长度(即Tinflection),该参数可帮助估计ARN患者抗病毒治疗期间坏死性视网膜炎的持续时间。
宏基因组测序有助于检测病原体的感染和基因变异,病毒DNA序列的读数与病毒拷贝数正相关,但无法直接反映拷贝数。
RNR基因的功能缺失变异(loss-of-function)可能导致VZV病毒毒力降低;但本研究中所检出的VZV变异尚未发现与临床病程或疾病程度相关。
参考文献
[1] Standardization of Uveitis Nomenclature (SUN) Working Group. Classification criteria for acute retinal necrosis syndrome. Am J Ophthalmol 2021;228:237–244.
[2] Schoenberger SD, Kim SJ, Thorne JE, et al. Diagnosis and treatment of acute retinal necrosis: a report by the American Academy of Ophthalmology. Ophthalmology 2017;124: 382–392.
[3] Lei B, Wang Z, Shu Q, et al. Observation of varicella zoster virus-induced acute retinal necrosis: viral load detection and visual outcome. Eye (Lond) 2022;36:1209–1216.
[4] Bernheim D, Germi R, Labetoulle M, et al. Time profile of viral DNA in aqueous humor samples of patients treated for varicella-zoster virus acute retinal necrosis by use of quantitative real-time PCR. J Clin Microbiol 2013;51: 2160–2166.
[5] Doan T, Wilson MR, Crawford ED, et al. Illuminating uveitis: metagenomic deep sequencing identifies common and rare pathogens. Genome Med 2016;8:90.
[6] Zhu J, Xia H, Tang R, et al. Metagenomic next-generation sequencing detects pathogens in endophthalmitis patients. Retina 2022;42:992–1000.
[7] Hafidi M, Janin-Manificat H, Denis P, et al. Acute retinal necrosis: virological features using quantitative polymerase chain reaction, Therapeutic management, and clinical outcomes. Am J Ophthalmol 2019;208:376–386.
[8] Shiraki K, Tan L, Daikoku T, et al. Viral ribonucleotide reductase attenuates the anti-herpes activity of acyclovir in contrast to amenamevir. Antivir Res. 2020;180:104829.
[9]Shiraki K, Takemoto M, Daikoku T. Emergence of varicellazoster virus resistance to acyclovir: epidemiology, prevention, and treatment. Expert Rev Anti Infect Ther 2021;19:1415–1425.
论文作者

常青 教授
复旦大学附属眼耳鼻喉科医院 教授、主任医师、博士生导师、玻璃体视网膜疾病学科主任
中国医师协会眼底病学组委员
中华医学会眼底病学组委员
中国医药教育协会眼科专业常委
中国女医师协会眼科专业委员
《中华眼底病杂志》、《眼科大查房》等杂志编委

周旻 副主任医师
复旦大学附属眼耳鼻喉科医院 副主任医师
擅长视网膜疾病的诊治,尤其是葡萄膜炎及各类眼内炎症性疾病的诊断和治疗

顾骏祥
复旦大学附属眼耳鼻喉科医院 主治医师、眼科学博士
