
摘要
子宫内膜癌是三大妇科恶性肿瘤之一,我国2022年子宫内膜癌的新发病例数约达7.77 万例,其中约 1.35 万例死亡。尽管多数早期子宫内膜癌患者预后良好,但仍有部分患者初诊时已是晚期。近年来,免疫治疗在子宫内膜癌领域取得了一定突破,化疗联合免疫治疗已被证实可改善晚期或复发性子宫内膜癌患者的生存预后。
不久前,FDA批准度伐利尤单抗(Imfinzi,英飞凡)用于与卡铂和紫杉醇联用后再进行Imfinzi单药治疗错配修复缺陷(dMMR)的成人原发晚期或复发性子宫内膜癌患者。此后不久,FDA批准帕博利珠单抗(Keytruda,可瑞达)用于与卡铂和紫杉醇联用后再进行Keytruda单药治疗成人原发晚期或复发性子宫内膜癌患者。FDA在短短时间里批准了两个子宫内膜癌一线治疗的免疫疗法,且在不到一年的时间里批准了三个子宫内膜癌一线免疫疗法,标志着子宫内膜癌的治疗全面进入了免疫治疗时代。
早期的免疫疗法
免疫疗法在子宫内膜癌中的应用最早可以追溯到2017年5月23日,FDA加速批准了Keytruda用于治疗后进展的、不可切除或转移性MSI-H/dMMR晚期实体瘤患者。这是首个获FDA批准的PD-1药物,也是首个泛癌种疗法。该适应症的获批基于KEYNOTE-158(NCT02628067)等多项研究。KENOTE-158的生物标志物研究分析了TMB-H患者的疗效,以TMB≥10个突变/Mb作为阈值。TMB-H组患者的ORR为29%,非TMB-H组的ORR为6%。内膜癌亚组分析中,TMB-H组ORR为47%(7/15),非TMB-H组为6%(4/67)。2020年6月16日,FDA批准了Keytruda单药用于治疗后进展的、不可切除或转移性TMB-H实体肿瘤患者。之后,基于KEYNOTE-775研究(NCT03517449),2021年7月22日,FDA批准了Keytruda联合仑伐替尼用于系统治疗后进展的MSS/pMMR子宫内膜癌患者。KEYNOTE-158研究的队列D/K纳入了90例MSI-H/dMMR的不可切除或转移性子宫内膜癌患者,ORR为46%,mDOR未达到(2.9,55.7+),mPFS为13.1个月,mOS未达到(27.2,NR)。据此,2022年3月21日,FDA批准了Keytruda单药用于系统治疗后进展的MSI-H/dMMR子宫内膜癌患者。
治疗子宫内膜癌的另一款PD-1单抗是Dostarlimab(Jemperli),2021年4月22日,FDA加速批准Jemperli用于含铂化疗后进展的dMMR子宫内膜癌成年患者,这一获批基于多中心、开放标签的 1 期剂量递增和队列扩展研究Garnet(NCT02715284)。MSI-H/dMMR队列的ORR为45.4%,MSS/pMMR队列的ORR仅为14.1%。同年8月17日,FDA加速批准其扩展适应症,用于治疗后进展的dMMR实体瘤成年患者。
除了以上FDA批准的适应证,NCCN指南推荐了纳武利尤单抗(欧狄沃,Opdivo)和Avelumab(Bavencio)用于MSI-H/dMMR子宫内膜癌患者。国内先后批准了恩沃利单抗(恩维达)、替雷利珠单抗(百泽安)、斯鲁利单抗(汉斯状)、普特利单抗(普佑恒)用于既往治疗失败的不可切除或转移性MSI-H/dMMR实体肿瘤患者。这些药物的临床研究中也纳入了一定数量的子宫内膜癌患者。
子宫内膜癌的一线免疫疗法
2023年7月31日,FDA批准Jemperli用于与卡铂和紫杉醇联用后再进行Jemperli单药治疗MSI-H/dMMR成人原发晚期或复发性子宫内膜癌患者,这是FDA批准的首个子宫内膜癌一线免疫疗法。其获批基于III期RUBY研究(NCT03981796),针对III/IV期dMMR/MSI-H患者,Jemperli组的mPFS为30.3个月,安慰剂组的mPFS为7.7个月,HR为0.29(p<0.0001)。随访24个月时,dMMR/MSI-H患者Jemperli组的OS率为83.3%,安慰剂组的OS率为58.7%,HR为0.3。由于Jemperli联合化疗在全人群中均显著延长了PFS(HR=0.64,p<0.01),OS也有所延长(HR=0.64,P=0.021,但大于预设的P=0.00177),NCCN指南推荐本疗法时并未限制必须为MSI-H/dMMR患者。


MSI-H/dMMR患者的PFS和OS
Imfinzi是首个获批子宫内膜癌适应症的PD-L1单抗,其获批基于III期DUO-E(NCT04269200)研究。研究纳入了初诊III/IV期和复发患者,设置了化疗,Imfinzi+化疗后Imfinzi单药维持治疗,以及Imfinzi+化疗后Imfinzi+奥拉帕利(Lynparza,利普卓)维持治疗三个组。在ITT人群中,与对照组相比,Imfinzi组的PFS获益具有统计学意义(HR=0.71,p=0.003)。在dMMR人群中,Imfinzi组的PFS获益更明显(HR=0.42),ORR为71.4%,mDOR未达到(2.4+,26.9+);对照组ORR为40.5%,mDOR为10.5个月。值得一提的是,本次Imfinzi+Lynparza维持治疗适应症未获批,可能是由于在dMMR人群中,与Imfinzi+化疗相比,再加用Lynparza并不能明显改善PFS(HR 0.42 vs 0.41)。但在ITT人群、pMMR人群和PD-L1阳性人群中,加用Lynparza可以观察到HR的降低。

dMMR患者的PFS
Keytruda的新适应症早在获批之前,就已被NCCN子宫肿瘤诊疗指南2023 v2版推荐,其获批基于III期KEYNOTE-868/NRG-GY018(NCT03914612)研究。研究纳入初诊III/IV期或复发性子宫内膜癌患者,未纳入癌肉瘤患者,因此NCCN指南的推荐排除了癌肉瘤患者。Keytruda联合化疗证明在dMMR和pMMR人群中均有获益。dMMR人群中,Keytruda组对比安慰剂组,PFS的获益具有统计学意义(HR=0.3,p<0.0001);pMMR人群的获益也具有统计学意义(HR=0.6,p<0.0001)。因此,FDA批准的适应症并未要求伴随诊断,但可以看出,dMMR人群获益更加明显。
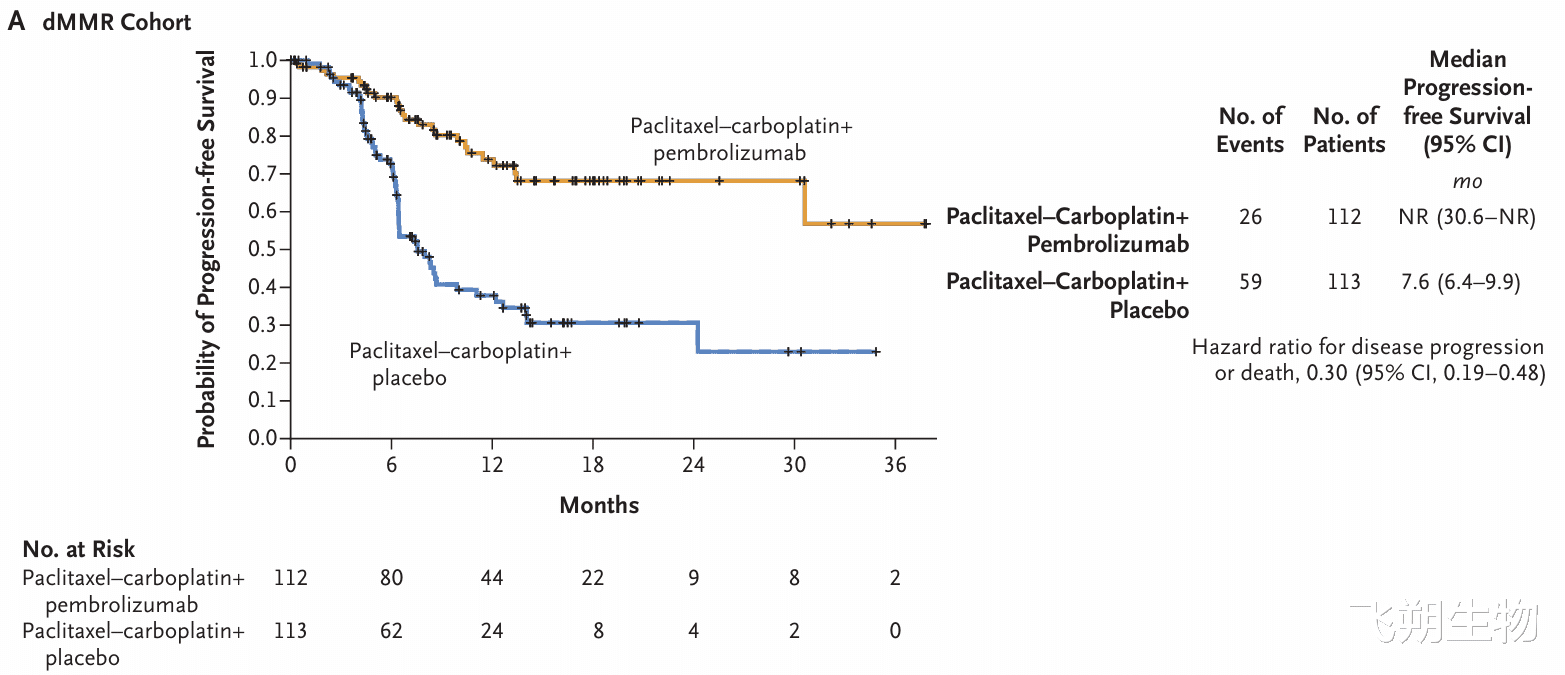
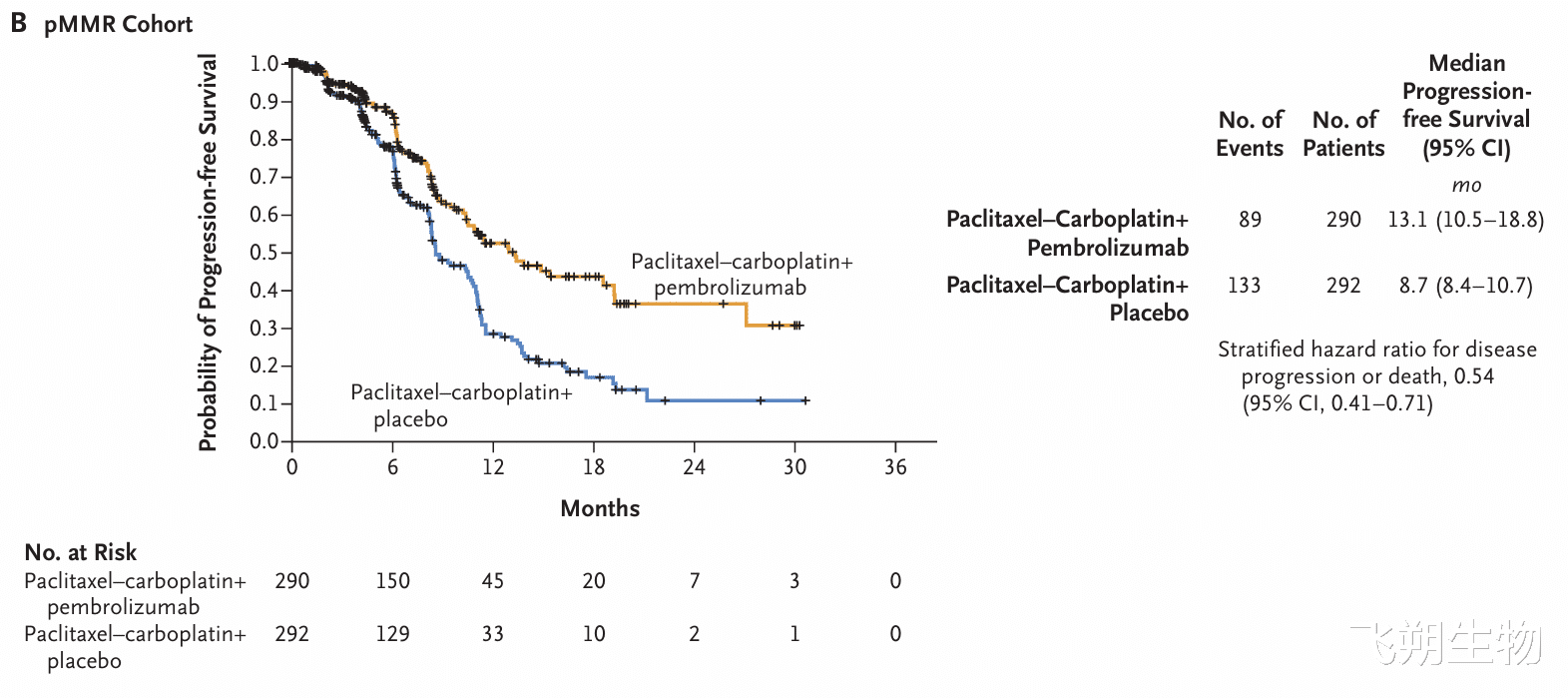
dMMR和pMMR人群的PFS
免疫治疗标志物
子宫内膜癌患者中有很大一部分适合免疫疗法,与其分子机制有关。一项研究纳入了32种肿瘤亚型的12,019个肿瘤样本,子宫内膜癌的dMMR频率高居榜首。TCGA研究中发现29%的子宫内膜癌为MSI-H高突变型,此外还有7%的POLE超突变型患者。POLE基因也是常见的免疫治疗正向因子,2024版NCCN结肠癌/直肠癌诊疗指南已将POLE/POLD1突变作为免疫检查点抑制剂的疗效标志物。POLE突变和MSI-H带来TMB的急剧上升(POLE超突变型为>100个突变/Mb,MSI-H高突变型为10~100个突变/Mb),而且有更显著的肿瘤新生抗原和TILs水平。
但也并非所有MSI-H的患者免疫治疗疗效都非常理想。近70%的MSI-H/dMMR子宫内膜癌患者是由MLH1基因启动子区高度甲基化所致。MLH1甲基化的子宫内膜癌患者与高龄、肥胖、晚期疾病显著相关。与MMR突变的肿瘤相比,MLH1甲基化肿瘤的TMB和TILs水平较低(P<0.01)。此外,MLH1甲基化肿瘤常见JAK1体系突变,而JAK1是常见的免疫治疗负向因子。MLH1甲基化肿瘤免疫治疗疗效不佳也已通过II期研究(NCT02899793)证实。复发性MSI-H/dMMR的子宫内膜癌患者使用Keytruda单药治疗,Lynch-Like患者的ORR为100%,甲基化患者仅有44%(p=0.024)。3年的PFS为100%比30%(p=0.017),OS为100%比43%(p=0.043)。

MLH1甲基化肿瘤的TMB和TILs水平较低,常见JAK1突变
总结
子宫内膜癌的免疫疗法总结见下表:

飞朔生物的子宫内膜癌分子分型单组织样本即可检测MSI,已经权威机构认证;亦可提供MLH1基因甲基化检测,全面提示子宫内膜癌患者免疫治疗疗效。飞朔致力于为肿瘤个体化精准医学检测提供最具创新性的产品和服务,并持续更新现有产品。
参考文献
[1] FDA官网数据库
[2] Lancet Oncol. 2020 Oct;21(10):1353-1365.
[3] J Clin Oncol. 2022 Mar 1;40(7):752-761.
[4] J Immunother Cancer. 2022 Jan;10(1):e003777.
[5] NCCN子宫肿瘤诊疗指南2024 v2
[6] NMPA官网数据库
[7] N Engl J Med. 2023 Jun 8;388(23):2145-2158.
[8] J Clin Oncol. 2024 Jan 20;42(3):283-299.
[9] N Engl J Med. 2023 Jun 8;388(23):2159-2170.
[10] Science. 2017 Jul 28;357(6349):409-413.
[11] Nature. 2013 May 2; 497(7447):67-73.
[12] NCCN结肠癌诊疗指南2024 v3
[13] NCCN直肠癌诊疗指南2024 v2
[14] JAMA Oncol. 2015;1(9):1319-1323.
[15] 中华妇产科杂志2023年10月第58卷第10期
[16] Clin Cancer Res. 2022 Oct 3;28(19):4302-4311.
[17] Cancer. 2022 Mar 15;128(6):1206-1218.
