2024年11月21日至24日期间,第29届神经肿瘤学会年会(2024 SNO)在美国德克萨斯州的休斯顿召开。在本次的2024 SNO年会上,研究人员公布了拉罗替尼(Larotrectinib)治疗TRK融合阳性原发性中枢神经系统(CNS)肿瘤儿童患者的有效性和安全性。
此前,2018年11月26日,美FDA已批准了拉罗替尼用于NTRK基因(包括NTRK1、NTRK2、NTRK3)融合的实体肿瘤成人及儿童患者。这是全球首个获批上市的与肿瘤类型无关的“广谱”抗癌药。
2022年4月13日,中国国家药监局(NMPA)官网公示,拉罗替尼胶囊正式在国内获批上市,用于治疗携带NTRK融合基因的实体瘤成人和儿童患者。
拉罗替尼是一种高效、高度选择性和具有中枢神经系统(CNS)活性的欧洲药品管理局(EMA)和FDA批准的TRK抑制剂。TRK(即原肌球蛋白受体激酶)是调节细胞通讯和肿瘤生长的重要信号通路,而NTRK是编码TRK的基因。在罕见情况下,NTRK基因会与其它基因融合,导致TRK信号通路不受控制,因而促进肿瘤的生长。NTRK基因融合在多种成人和儿童实体肿瘤中具有结构性活性,并作为致癌驱动因子。

商品名:VITRAKVI(维泰凯)
通用名:Larotrectinib(拉罗替尼)
靶点:NTRK
厂家:Bayer 联合Loxo Oncology
美国首次获批:2018年11月
中国首次获批:2022年4月
规格:25mg/100mg(胶囊)、20mg/ml(口服液)
获批适应症:NTRK基因融合的实体瘤(中国)
推荐剂量:
对于体表面积大于1㎡的成人或儿童患者,推荐剂量为100mg每次,每天两次,与食物或不与食物同服皆可;
对于体表面积小于1㎡的儿童患者,推荐剂量为100mg/㎡(按体表面积计算)每次,每天两次,与食物或不与食物同服皆可。
储存条件:常温20℃-25℃
临床数据
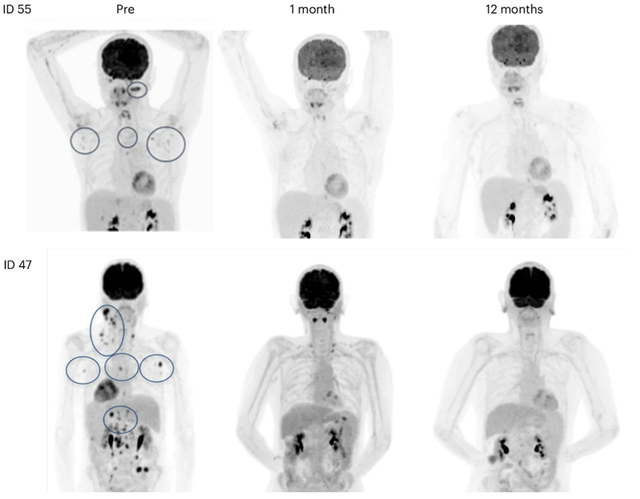
在这项分析中,研究人员通过两项临床试验评估了拉罗替尼治疗TRK融合阳性原发性中枢神经系统肿瘤患者的临床结果。总共有55例TRK融合阳性的原发性中枢神经系统肿瘤患者被纳入本分析。研究的主要终点是IRC根据神经肿瘤学标准的反应评估评估的客观缓解率(ORR);次要终点包括持续缓解时间(DOR)、无进展生存期(PFS)、总生存期(OS)和安全性。
儿童患者组(n=38)的总体客观缓解率(ORR)为37%,24周的疾病控制率(DCR)为74%。在成人患者组(n=1)中,这些比率分别为6%和12%。在儿童和成人肿瘤患者中,最佳的总体缓解分别包括完全缓解(CR分别为8%和0%),部分缓解(PR分别为29%和6%),病情稳定(SD分别为45%和41%)和进展性疾病(PD分别为13%和41%);然而,一些患者无法评估(NE分别为5%和12%)。
关于无进展生存期(PFS),在儿童患者中,中位随访时间为40个月,中位PFS为20个月,3年PFS率为43%。在成人患者中,中位随访时间为5个月,中位PFS为3个月,3年PFS率为0。
关于生存期(OS),在儿童患者中,中位随访时间为46个月时,中位OS未达到,3年OS率为64%。在成人患者中,中位随访时间为19个月,中位OS为19个月,3年OS率为15%。
此外,儿童患者的中位持续缓解时间(DOR)为17个月,3年DOR率为37%。在成人患者中,中位DOR为11个月,3年DOR率为0%。
安全性
在安全性方面,治疗相关不良反应(TRAEs)发生在58.2%的患者中,主要是1/2级;3/4级TRAEs发生在9.1%的患者中。TRAEs包括γ -谷氨酰转移酶水平升高、高血糖、高钠血症、低钠血症、中性粒细胞计数减少和转氨酶水平升高。研究人员指出,没有患者因TRAE而停止治疗。然而,14.5%的患者发生了与治疗无关的治疗中断。
最常见的TRAE包括谷丙转氨酶升高(23.6%)、天冬氨酸转氨酶升高(16.4%)、贫血(9.1%)、呕吐(5.5%)、头痛(3.6%)、腹泻(1.8%)和咳嗽(1.8%)。5.5%的患者发生了严重的TRAE,14.5%的患者因TRAE而需要调整剂量。
小结
拉罗替尼在TRK融合阳性的原发性中枢神经系统肿瘤儿童患者中产生了快速持久的反应和高DCR。
【重要提示】所有文章信息仅供参考,具体治疗谨遵医嘱!