2023年对于生物医药行业而言是具有里程碑意义的一年,在这一年中美国、欧洲、日本与中国均积极推动新药创制和新兴技术发展,在针对新型疾病的治疗方案、基因编辑技术等领域获得重大突破,利用人工智能/大数据等先进技术提升了研发效率和质量,全球生物医药行业在创新、市场需求、产业链整合和国际化等方面呈现出积极的发展趋势。本文梳理与总结2023年美国、欧洲、日本和中国获批上市的新药,并对2024年新药研发和生物医药发展态势进行展望,以期为新药研发相关研究提供参考。
关键词
创新药; 首创类药物; 细胞与基因治疗; 孤儿药; 基因编辑

伴随医药科技的迅猛发展以及临床需求的与日俱增,创新药研发业已化作引领全球医疗健康领域阔步前行的核心驱动力。在 2023 年,全球新型冠状病毒感染渐趋受控,经济的复苏为创新药研发赋予了更为充裕的资金以及市场契机,全球生物医药市场的规模不断延展,创新药研发的投入与产出皆达成了显著的提升。然而,地缘政治的紧张等要素给全球创新药研发带来了一定程度的挑战和不确定性。美国于创新药研发的全球竞技舞台中依旧占据主导地位,欧洲与日本亦保持着强劲的竞争力。中国、印度等新兴市场国家凭借庞大的患者基数、独有的疾病谱、持续优化的政策环境以及日益提升的研发能力,逐步演变为全球新药研发的关键力量。本文针对 2023 年美国、欧洲、日本和中国获批上市的新药予以梳理并着重介绍,同时对 2024 年新药研发和生物医药的发展趋向进行展望,意在为新药研发的相关研究提供参照。2023 年之前已获批上市药物的相关仿制药、新剂型、新适应证以及血液制品等不在本文的讨论范畴之列。

01 2023年美国FDA批准的全新药物
2023年美国FDA药品评估和研究中心(Center of Drug Evaluation and Research,CDER)共批准了55款新药(见表1),其在药物设计、作用机制和治疗效果方面展现出高度创新性。20款(36%)为首创类药物(first-in-class),其适应症范围广泛,涵盖肿瘤、感染、神经系统疾病、罕见病等多个领域,其中,罕见病领域的成绩尤为突出,有28款药物(51%)以孤儿药资格获批。
按治疗领域划分,肿瘤学领域获批药物最多,CDER在2023年批准了13款抗肿瘤药物(24%); 神经学领域排名第2,9款药物(16%)获批; 传染病学和血液学领域并列第3,各有5款药物(9%)获批⁽¹⁾。CDER通过综合应用各种加速开发与审评审批的方法,使得具有显著疗效或针对严重未被满足临床需求的药物更早惠及患者。55款获批新药中,25款(45%)被授予快速通道(fast track)资格,9款(16%)获突破性疗法(breakthrough therapy)认定,31款(56%)获优先审评(priority review)资格,9款(16%)获加速审批(accelerated approval); 共有36款(65%)使用了快速通道、突破性疗法、优先审评和加速审批中的至少1种加速程序⁽²⁾。








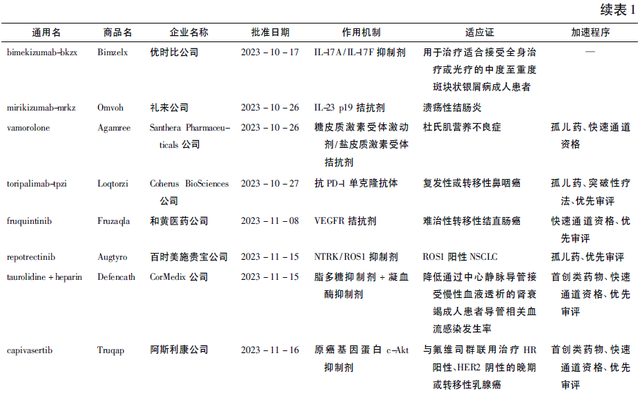

2023年美国FDA生物制品评价与研究中心(Center for Biologics Evaluation and Research,CBER)批准了25款产品,涉及细胞和基因疗法、疫苗和血液制品⁽³⁾。值得一提的是由Vertex公司与CRISPR公司合作开发的exagamglogene autotemcel(商品名: Casgevy)于2023年12月8日获批上市,该产品是一种基于CRISPR/Cas9基因编辑技术的疗法,用于治疗12岁及以上反复出现血管阻塞性危机(vaso-occlusive crisis,VOC)的镰状细胞病(sickle cell disease,SCD)患者,其作为全球首个获批的CRISPR/Cas9基因编辑疗法,在生物医药行业发展过程中极具里程碑意义。
02 2023年欧盟批准的全新药物
2024年初欧洲EMA发布了Human Medicines Highlights2023手册,该手册概述了欧洲EMA关于人用药品的重大决定和推荐,77款产品获得积极意见。其中新活性物质39款、优先药物计划(priority medicines,PRIME)认定药物3款、孤儿药17款、生物类似药8款、先进技术治疗医学产品(advanced ther-apy medicinal product,ATMP) 1款; 产品数量最多的适应证依次为肿瘤(25款)、神经疾病(11款)与心脏疾病(6款)⁽⁴⁾。
pegunigalsidase alfa(商品名: Elf-abrio),lebrikizumab(商品名: Ebglyss)与palopeg-teriparatide(商品名: Yorvipath)先于其他国家首次在欧洲获批(其中pegunigalsidase alfa在2023年5月相继获得了欧洲EMA与美国FDA的批准,欧洲EMA的批准时间略早于美国FDA,见表2)。前述基因编辑疗法产品Casgevy也被欧洲EMA予以重视和积极推荐,但其最先在英国获批(2023年11月16日),直至2024年2月13日才获欧盟批准。

03 2023年日本批准的全新药物
2023年日本医药品和医疗器械局(Pharmaceuti-cals and Medical Devices Agency,PMDA)共批准106款新药,其中新活性成分新药数量达30款,以疫苗和抗肿瘤药居多,约占新活性成分新药数量的1/3。mirikizumab(商品名: Omvoh),zilucoplan(商品名: Zilbrysq)与ARCT-154(商品名: コスタイベ筋注用)先于其他国家首次在日本获批(见表3)。

ARCT-154由CSL公司与Arcturus therapeutics公司共同开发,作为全球首个自扩增mRNA(self-amplifying mRNA,sa-mRNA)抗COVID-19疫苗,成为2023年度获批药物中备受瞩目的产品。sa-mRNA技术可诱导较强的细胞免疫反应并延长保护期,同时使mRNA剂量明显减少,有可能成为持久的疫苗选择⁽⁵⁾。
04 2023年中国批准的1类创新药
在药品审评审批制度改革不断深化的背景下,我国国家药品监督管理局(National Medical Products Administration,NMPA)致力于加速临床急需新药、儿童用药以及罕见疾病用药的上市进程。2023年NMPA以临床价值为导向,采取多项举措使得获批上市的新药数量稳步增长、药品审评审批速度明显加快,从而为患者带来更多获益。
2024年2月国家药品监督管理局药品审评中心(Center for Drug Evaluation,CDE)发布了《2023年度药品审评报告》,报告指出2023年共有40款1类新药获批,其中化学药19款、预防用生物制品2款、治疗用生物制品14款、中药5款,36款新药先于其他国家首次在中国获批。获批产品涉及最多的2种适应证分别为肿瘤和感染性疾病,数量分别为16款(40%)和8款(20%)。本文仅列出使用了至少1种加快程序的1类新药(共15款,见表4),其中9款(22.5%)通过优先审评审批程序获批,13款(32.5%)为附条件批准上市,8款(20%)在临床研究阶段纳入了突破性治疗药物程序,4款(10%) COVID-19治疗药物通过特别审批程序获批。此外,2023年NMPA批准罕见病用药45款、儿童用药92款、CAR-T细胞治疗产品3款、境外已上市、境内未上市的原研药品86款⁽⁶⁾,以下不再详述。


HCV: 丙型肝炎病毒; DLBCL: 弥漫大B 细胞淋巴瘤
05 2024年生物医药领域展望
2023年底至2024年初,已有多家机构如Evaluate公司、科睿唯安公司等对2024年可能最值得关注的药物进行了展望。Evaluate公司报道了2024年可能最有价值的10个管线,其中诺和诺德公司与礼来公司治疗糖尿病和肥胖症的新药、罗氏公司的TIGHT靶向抗体与强生公司治疗自身免疫性疾病新药尤其引人关注。10个重磅在研管线中小分子药物高达7款,单抗2款,多肽药物1款,可见小分子药物在生物医药领域仍占据重要地位⁽⁷⁾。科睿唯安公司发布《最值得关注的药物预测》报告,介绍了13种可能在2024年进入市场的新疗法和新药物,其适应证覆盖乳腺癌、A型血友病、镰状细胞病、克罗恩病、溃疡性结肠炎、RSV感染和多发性骨髓瘤等临床需求未被满足的疾病领域,并预测这些药物在2029年前将成为“重磅炸弹药物”,其可能改变临床治疗模式,从而使患者受益⁽⁸⁾。

此外,2024年生物医药领域将展现出更为多元化、个性化和智能化的发展趋势。基于2023年首个CRISPR/Cas9基因编辑产品成功获批,基因编辑技术可能取得更为显著的突破,为罕见遗传病的治疗带来希望,并引领个性化医疗新时代来临; 细胞疗法在再生医学、肿瘤治疗等领域的应用将会更加广泛,而免疫疗法也会继续保持热度,在更多疾病领域发挥重要作用; 人工智能(artificial intelligence,AI)将进一步释放其巨大潜力,帮助药物研发机构降本增效,从而更快地为患者提供创新药物,这些热门领域和技术突破将共同推动创新药研发迈向新的高峰。

06 结语与展望
从全球视角来看,2023年无疑是创新药的丰收之年。与2022年相比,2023年新药不仅在数量上实现了增长,更在质量和疗效上取得了显著突破。多款针对肿瘤、罕见病、神经系统疾病等领域的新药获批上市,为全球患者带来了全新的治疗选择。同时CRISPR/Cas9基因编辑技术、mRNA疫苗技术、AI等新兴技术的快速发展充分赋能新药与生物制品研发,推动其向更高效、更精准和更个性化的方向发展。

2023年我们见证了中国新药稳健发展与走向世界舞台,3款国产创新药———特瑞普利单抗(toripalimab,由上海君实生物医药科技股份有限公司研发,其合作伙伴Coherus BioSciences公司负责该产品在美国和加拿大的开发和商业化)、呋喹替尼(fruquintinib,由和黄医药公司研发)以及艾贝格司亭α注射液(efbemalenograstim alfa,由亿帆医药股份有限公司研发)在美国获批上市,反映出本土制药企业创新质量的提升,其产品价值已开始获得国际认可⁽⁹⁾。

需要强调的是,全球生物医药领域仍面临诸多挑战,如何在药物创新性与安全性之间寻求平衡点、如何确保新药可及性和可负担性以及如何加强国际合作与交流等问题,仍需我们共同努力与探索。总体而言,2023年全球上市新药呈现出积极向好的态势,我们期待更多具有全新机制与卓越疗效的药物在未来问世,造福广大患者。
来源:《中国新药杂志》 2024年 第33卷第16期
作者:杨臻峥,苏晓语,孙友松,陈倩,王昀。中国药科大学《药学进展》编辑部;中国药科大学多靶标天然药物全国重点实验室;上海递鸽医药科技有限公司;奥克兰大学;南京医科大学附属妇产医院/南京市妇幼保健院
