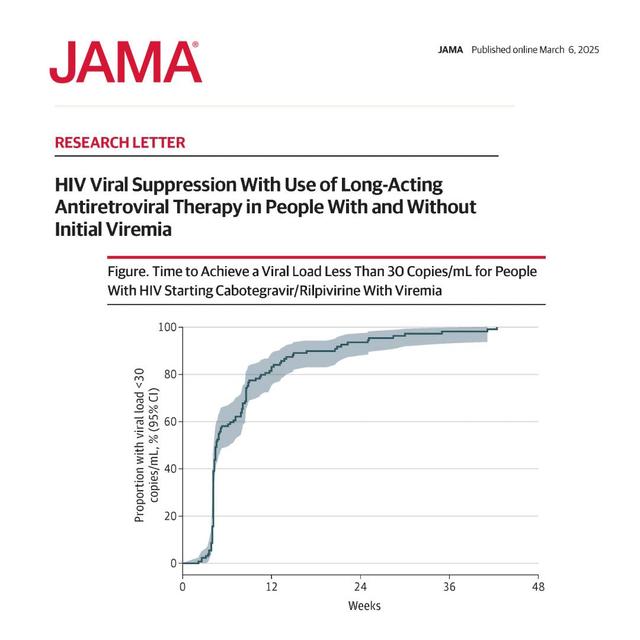
默克公司在3月9日至12日在加利福尼亚州旧金山举行的2025年逆转录病毒和机会性感染会议(CROI)上公布了其用于治疗HIV-1的研究性每日一次口服两种药物方案MK-8591A(doravirine/islatravir,简称DOR/ISL)的两项3期试验的积极结果。这些试验证明在第48周时维持病毒抑制不劣于现有疗法,且安全性相似。

MK-8591A是研究性治疗组合,具有互补的抗逆转录病毒疗法(ART)作用机制和耐药性特征,并通过单片方案每日给药。其成分islatravir是默克公司在研的核苷逆转录酶易位抑制剂。
MK-8591A与现有疗法对照试验两项试验为开放标签、随机、活性对照MK-8591A-051试验(NCT05631093,N=551)和双盲、随机、活性对照MK-8591A-052试验(NCT05630755,N=513),分别评估了通过抗逆转录病毒疗法和必妥维(BIC/FTC/TAF)实现至少3个月病毒学抑制的HIV-1患者改用MK-8591A的疗效和安全性。
所有研究患者均无已知的治疗失败或DOR耐药史。两项试验受试者按2:1的比例随机分配改用MK-8591A(n=366、n=342),或继续使用初始ART方案(n=185)、必妥维(n=171)。
共同主要疗效终点是第48周HIV-1 RNA≥50拷贝/ml的患者百分比。非劣效性界限定义为4%。
两项试验结果摘要在开放标签试验MK-8591A-051中,结果显示,改用MK-8591A治疗的患者中有1.4%在第48周病毒载量≥50拷贝/mL,而接受初始ART方案的患者中这一比例为4.9%(治疗差异-3.6%,95%CI-7.8,-0.8)。在第48周,改用MK-8591A的患者中有95.6%维持了病毒抑制(HIV-1 RNA<50拷贝/毫升),而继续使用初始ART的患者中这一比例为91.9%(治疗差异3.7%,95%CI,0.3至8.9)。
在双盲试验MK-8591A-052中,结果显示,在第48周,MK-8591A组和必妥维组的大多数患者(分别为91.5%和94.2%)均表现出HIV病毒学抑制。1.5%的改用MK-8591A的患者和0.6%的继续使用必妥维的患者没有达到维持HIV病毒学抑制(治疗差异[TD],0.9%;95%CI,-1.9至2.9)。
在两项试验中,MK-8591A的安全性与对照抗逆转录病毒方案(包括MK-8591A-052中的必妥维)大致相当。在第48周,MK-8591A和对照方案的总淋巴细胞和CD4计数的平均百分比变化相似。在两项试验中均未观察到对MK-8591A的两种成分的治疗引起的耐药性。
关注点两项试验数据证明了MK-8591A与ART方案之间的非劣效性。MK-8591A的疗效与三药方案相当,有望成为首个不含整合酶抑制剂的双药方案。随着HIV患者年龄的增长和合并症的出现,简化的治疗方案可能会为患者带来益处。默克公司表示,计划于2025年中期开始向监管机构提交MK-8591A的上市许可申请。
参考来源:‘Merck Announces Positive Data from Phase 3 Trials that Show the Investigational, Once-Daily, Oral, Two-Drug Regimen of Doravirine/Islatravir (DOR/ISL) Maintained HIV-1 Viral Suppression at Week 48’,新闻稿。Merck;美国东部时间2025年3月12日发布。
注:本文旨在介绍医药健康研究,不作任何用药依据,具体用药指导,请咨询主治医师。